Concours UE1 2015/2016 - Q1
+3
Momo
Paullinec
Laurine_W
7 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2015-2016
Page 1 sur 1
 Concours UE1 2015/2016 - Q1
Concours UE1 2015/2016 - Q1
Bonsoir,
j'ai un souci concernant les propositions avec la longueur de la liaison !
Je pense avoir compris qu"il faut utiliser la formule rKCl = rK + rCl - 0.09 (XK-XCl) ?!
en calculant le dernier terme, j'obtiens -0.2106
Mais du coup, après je n'arrive pas à trouver comment déterminer si la longueur de liaison est égale, inférieure ou supérieure ...
je pensais calculer les rayons covalents, mais je ne sais pas comment m'y prendre ...
Merci d'avance
j'ai un souci concernant les propositions avec la longueur de la liaison !
Je pense avoir compris qu"il faut utiliser la formule rKCl = rK + rCl - 0.09 (XK-XCl) ?!
en calculant le dernier terme, j'obtiens -0.2106
Mais du coup, après je n'arrive pas à trouver comment déterminer si la longueur de liaison est égale, inférieure ou supérieure ...
je pensais calculer les rayons covalents, mais je ne sais pas comment m'y prendre ...
Merci d'avance

Paullinec- Messages : 80
Date d'inscription : 09/10/2016
 Re: Concours UE1 2015/2016 - Q1
Re: Concours UE1 2015/2016 - Q1
Salut, en faite cette question est beaucoup plus simple que tu ne le penses.
Tu as juste à regarder la formule, il n'y a pas de calcul à faire.
Je n'ai pas le sujet devant moi (la prochaine fois met le sujet pour que l'on puisse te répondre car nous ne les avons pas forcément:) ).
Mais sinon tu vois que dans ta formule tu as -0.09 ce qui te dit que la liaison va être plus petite .
.
Bon courage
Tu as juste à regarder la formule, il n'y a pas de calcul à faire.
Je n'ai pas le sujet devant moi (la prochaine fois met le sujet pour que l'on puisse te répondre car nous ne les avons pas forcément:) ).
Mais sinon tu vois que dans ta formule tu as -0.09 ce qui te dit que la liaison va être plus petite
Bon courage
Laurine_W- Messages : 92
Date d'inscription : 18/04/2015
 Re: Concours UE1 2015/2016 - Q1
Re: Concours UE1 2015/2016 - Q1
Merci de ta réponse !
J'ai cherché un peu trop compliqué !
J'ai cherché un peu trop compliqué !

Paullinec- Messages : 80
Date d'inscription : 09/10/2016
 Question 1
Question 1
Et du coup pour cette question, est ce que c'est possible que la liaison K-Cl soit covalente pure et majoritairement ionique?
Momo- Messages : 60
Date d'inscription : 30/10/2016
 Question 1
Question 1
Bonjour,
je rebondis sur le sujet car dans le poly il est dit que d eq = longueur de la liaison, =2X le rayon de covalence
Et que la formule rAB = rA + rB - 0,09 (Xa - Xb) c'est pour la largueur de la liaison.
Du coup je voulais si j'ai mal compris les formule ou bien si c'est la réponse C ?
Merci d'avance!
je rebondis sur le sujet car dans le poly il est dit que d eq = longueur de la liaison, =2X le rayon de covalence
Et que la formule rAB = rA + rB - 0,09 (Xa - Xb) c'est pour la largueur de la liaison.
Du coup je voulais si j'ai mal compris les formule ou bien si c'est la réponse C ?
Merci d'avance!
ysoline- Messages : 30
Date d'inscription : 11/11/2016
 Re: Concours UE1 2015/2016 - Q1
Re: Concours UE1 2015/2016 - Q1
Salut Momo,
Alors pour connaître si une liaison est covalent il faut que tu saches chacun des atomes apporte un électron (ici oui) et pour savoir si elle est ionique il faut que ta différence d'electronégativité soit égale ou supérieure à 2.
Salut ysoline, pour moi la deq est utilisée pour les liaisons covalentes non polaire alors que la formule intervient pour les liaisons polarisées dans lesquelles on retrouve ment un raccourcissement.
Remets la proposition je n'ai pas le sujet.
Bon courage.
Alors pour connaître si une liaison est covalent il faut que tu saches chacun des atomes apporte un électron (ici oui) et pour savoir si elle est ionique il faut que ta différence d'electronégativité soit égale ou supérieure à 2.
Salut ysoline, pour moi la deq est utilisée pour les liaisons covalentes non polaire alors que la formule intervient pour les liaisons polarisées dans lesquelles on retrouve ment un raccourcissement.
Remets la proposition je n'ai pas le sujet.
Bon courage.

Raphael18- Messages : 271
Date d'inscription : 20/11/2014
Age : 27
 Re: Concours UE1 2015/2016 - Q1
Re: Concours UE1 2015/2016 - Q1
Salut,
dans le cas d'un énoncé comme celui-ci, comment sait-on si la liaison est covalente ? Comment sait-on si ce sont les 2 atomes qui fournissent un électrons ? La j'imagine que c'est parce que ce sont des atomes simples et si c'était des ions ce ne serait plus covalent ?
Par exemple, je comprend le cas du H+ qui ne donne pas d'électrons puisqu'il n'en a plus, mais par exemple si on prend Li+, celui-ci a perdu son électron de valence donc du coup il ne donnera pas d'électron, c'est ca ?
Si ce raisonnement est bon ca veut dire que seul les alcalin peuvent former des liaisons datives ?
merci !!
dans le cas d'un énoncé comme celui-ci, comment sait-on si la liaison est covalente ? Comment sait-on si ce sont les 2 atomes qui fournissent un électrons ? La j'imagine que c'est parce que ce sont des atomes simples et si c'était des ions ce ne serait plus covalent ?
Par exemple, je comprend le cas du H+ qui ne donne pas d'électrons puisqu'il n'en a plus, mais par exemple si on prend Li+, celui-ci a perdu son électron de valence donc du coup il ne donnera pas d'électron, c'est ca ?
Si ce raisonnement est bon ca veut dire que seul les alcalin peuvent former des liaisons datives ?
merci !!

poissond'eaudouce <3- Messages : 348
Date d'inscription : 08/10/2017
 Re: Concours UE1 2015/2016 - Q1
Re: Concours UE1 2015/2016 - Q1
Salut,
Ici je dirais que tu ne peux pas savoir si la liaison est formée à partir d'ions ou à partir d'atomes simples. Je pense que le terme de covalence pure se rapporte plutôt au partage finale des charges dans la liaison et non pas à la formation de la liaison. Ici la liaison n'est pas covalente pure car il y a une différence d'électronégativité K et Cl et donc la liaison est polarisée (un liaison covalente pure n'existe que lors d'une liaison entre 2 mêmes atomes).
Ensuite pour répondre à ta deuxième question, il n'y a pas que les alcalins qui peuvent former des liaisons datives, par exemple dans le monoxyde de carbone un des doublets liants est fournie entièrement par l'oxygène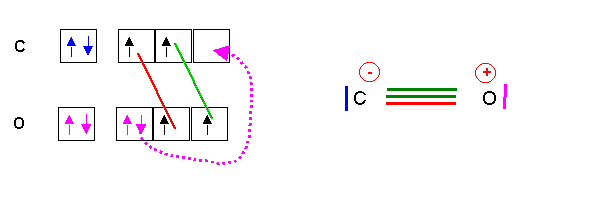
J'espère que c'est suffisament clair ?
Bon courage
Ici je dirais que tu ne peux pas savoir si la liaison est formée à partir d'ions ou à partir d'atomes simples. Je pense que le terme de covalence pure se rapporte plutôt au partage finale des charges dans la liaison et non pas à la formation de la liaison. Ici la liaison n'est pas covalente pure car il y a une différence d'électronégativité K et Cl et donc la liaison est polarisée (un liaison covalente pure n'existe que lors d'une liaison entre 2 mêmes atomes).
Ensuite pour répondre à ta deuxième question, il n'y a pas que les alcalins qui peuvent former des liaisons datives, par exemple dans le monoxyde de carbone un des doublets liants est fournie entièrement par l'oxygène

J'espère que c'est suffisament clair ?
Bon courage
Lenouch- Messages : 136
Date d'inscription : 07/02/2017
Age : 25
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2015-2016
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|
