TK2 QCM25 nombre d'oxydation
5 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: CHIMIE GENERALE :: TK & Tutos 2017-2018
Page 1 sur 1
 TK2 QCM25 nombre d'oxydation
TK2 QCM25 nombre d'oxydation
H3C-C=O
\NH - CH3
Je sais que dans cette molécule :
H = +I
O = - II
C = -III
Mais comment fait-on pour connaitre le nombre d'oxydation de N et des C ?
\NH - CH3
Je sais que dans cette molécule :
H = +I
O = - II
C = -III
Mais comment fait-on pour connaitre le nombre d'oxydation de N et des C ?
petite8- Messages : 147
Date d'inscription : 19/11/2016
 Re: TK2 QCM25 nombre d'oxydation
Re: TK2 QCM25 nombre d'oxydation
Tu recherches qui entre N ou C est le plus électronégatif.
Bon courage !
Bon courage !

Raphael18- Messages : 271
Date d'inscription : 20/11/2014
Age : 27
 Re: TK2 QCM25 nombre d'oxydation
Re: TK2 QCM25 nombre d'oxydation
Je suis désolée, mais je ne comprends pas ce qu'on doit faire une fois que l'on a cherché lequel etait le plus électronégatif ...
Est xe que tu pourrais m'expliquer (un peu plus détaille) comment déterminer l'oxydation du C et du N, s'il te plaît?
Est xe que tu pourrais m'expliquer (un peu plus détaille) comment déterminer l'oxydation du C et du N, s'il te plaît?
Alix.c- Messages : 38
Date d'inscription : 25/09/2017
 Re: TK2 QCM25 nombre d'oxydation
Re: TK2 QCM25 nombre d'oxydation
Salut,
Pour ce type d'exercice, quand tu as la molécule de dessinée tu vas venir casser chacune des liaisons et donner les électrons à l'atome le plus electronegatif de la liaison.
De ce fait, cet atome va recevoir 1 e- supplémentaire et gagner une charge négative. L'autre atome perd un e- et gagne donc une charge positive.
Tu appliques cette règle pour toutes les liaisons puis pour Chaque atome tu fais la somme des charges + et - gagnées et tu retrouves son nombre d'oxydation.
Est ce que c'est plus clair comme ça?
Bon courage
Pour ce type d'exercice, quand tu as la molécule de dessinée tu vas venir casser chacune des liaisons et donner les électrons à l'atome le plus electronegatif de la liaison.
De ce fait, cet atome va recevoir 1 e- supplémentaire et gagner une charge négative. L'autre atome perd un e- et gagne donc une charge positive.
Tu appliques cette règle pour toutes les liaisons puis pour Chaque atome tu fais la somme des charges + et - gagnées et tu retrouves son nombre d'oxydation.
Est ce que c'est plus clair comme ça?
Bon courage

Raphael18- Messages : 271
Date d'inscription : 20/11/2014
Age : 27
 Re: TK2 QCM25 nombre d'oxydation
Re: TK2 QCM25 nombre d'oxydation
Saluuut,
Je relance le sujet parce que je ne comprends pas ce principe de "casser la liaison" et tout
Pouvez vous me réexpliquer?
Merci beaucoup d'avance
Je relance le sujet parce que je ne comprends pas ce principe de "casser la liaison" et tout
Pouvez vous me réexpliquer?
Merci beaucoup d'avance
chouette- Messages : 115
Date d'inscription : 01/11/2017
 Re: TK2 QCM25 nombre d'oxydation
Re: TK2 QCM25 nombre d'oxydation
Salut !
Quand on parle de ''casser'' les liaisons, c'est une image !
Pour déterminer le nombre d'oxydation d'un atome dans une molécule, on va comparer l'électronégativité de cet atome avec celle des atomes auxquels il est relié.
Par exemple si tu as une liaison O-H, tu sais que l'oxygène est plus électronégatif que l'hydrogène, donc si on cassait la liaison, ce serait l'oxygène qui récupérerait les 2 électrons de la liaison. On aurait donc un oxygène chargé - et un hydrogène chargé +.
Ici la liaison ne se casse pas réellement (c'est pour ça qu'on dit que le nombre d'oxydation est une valeur théorique), mais l'oxygène va avoir tendance à attirer à lui les électrons.
Si on reprend l'exemple donné plus haut, on a la molécule suivante :
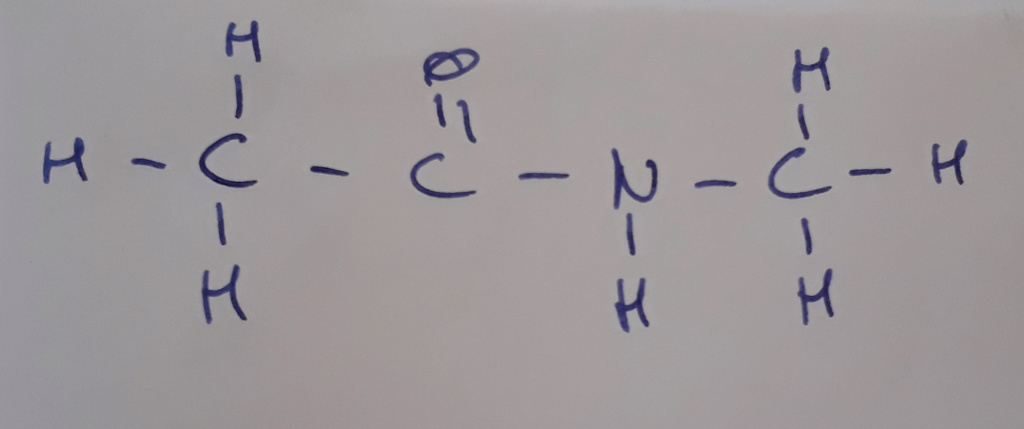
Si on s'intéresse au premier carbone, on voit qu'il est relié à 3 hydrogènes et à un autre carbone.
Entre l'hydrogène et le carbone, c'est le carbone qui est le plus électronégatif, donc c'est lui qui va attirer les électrons de la liaisons.
Entre les deux carbones, il n'y a pas de différence d'électronégativité, donc pas de ''tirage'' d'électrons.
Ainsi, le carbone ''reçoit'' théoriquement 3 électrons (1 par H), il sera donc en -III, tandis que chaque hydrogène sera en +I.
Le deuxième carbone est relié à un oxygène, un carbone et un azote.
Entre l'oxygène et le carbone, c'est l'oxygène qui est le plus électronégatif, donc c'est lui qui va attirer les électrons. En plus c'est une double liaison, donc il peut attirer 2 électrons !
L'azote est également plus électronégatif que le carbone, donc il va aussi attirer un électron.
Entre les deux carbones c'est toujours pareil, il ne se passe rien.
Ainsi, le deuxième carbone ''perd'' 2 électrons par sa liaison avec l'oxygène, et 1 électron par sa liaison avec l'azote.
On a donc un oxygène en -II, et un carbone en +III.
L'azote est relié à 2 carbones et à un hydrogène. Il est plus électronégatif que le carbone et l'hydrogène, alors il va attirer un électron pour chaque liaison.
Il sera donc en -III, et l'hydrogène auquel il est relié en +I.
Le dernier carbone est relié à 3 hydrogènes et à un azote.
Il est plus électronégatif que l'hydrogène, alors il attirera à lui un électron par liaison avec un hydrogène (donc 3 au total).
Il est moins électronégatif que l'azote, alors il perdra un électron dans sa liaison avec l'azote.
Au total, il gagne 3 électrons mais en perd 1, il sera donc en -II.
Les hydrogènes auxquels il est relié seront en +I.
Ce qui donne :
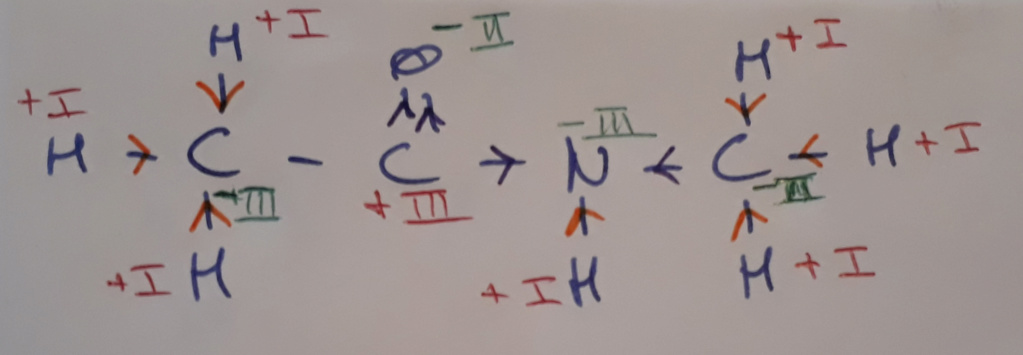
Et si tu fais la somme des nombres d'oxydation de chaque atome, tu obtiens 0, ce qui correspond bien à la charge de la molécule (qui est nulle).
Est-ce que ça te semble plus clair ?
Quand on parle de ''casser'' les liaisons, c'est une image !
Pour déterminer le nombre d'oxydation d'un atome dans une molécule, on va comparer l'électronégativité de cet atome avec celle des atomes auxquels il est relié.
Par exemple si tu as une liaison O-H, tu sais que l'oxygène est plus électronégatif que l'hydrogène, donc si on cassait la liaison, ce serait l'oxygène qui récupérerait les 2 électrons de la liaison. On aurait donc un oxygène chargé - et un hydrogène chargé +.
Ici la liaison ne se casse pas réellement (c'est pour ça qu'on dit que le nombre d'oxydation est une valeur théorique), mais l'oxygène va avoir tendance à attirer à lui les électrons.
Si on reprend l'exemple donné plus haut, on a la molécule suivante :
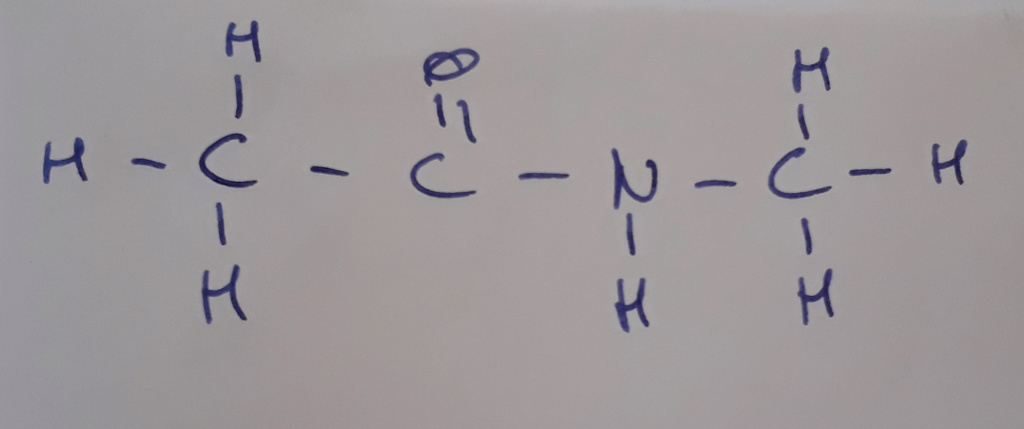
Si on s'intéresse au premier carbone, on voit qu'il est relié à 3 hydrogènes et à un autre carbone.
Entre l'hydrogène et le carbone, c'est le carbone qui est le plus électronégatif, donc c'est lui qui va attirer les électrons de la liaisons.
Entre les deux carbones, il n'y a pas de différence d'électronégativité, donc pas de ''tirage'' d'électrons.
Ainsi, le carbone ''reçoit'' théoriquement 3 électrons (1 par H), il sera donc en -III, tandis que chaque hydrogène sera en +I.
Le deuxième carbone est relié à un oxygène, un carbone et un azote.
Entre l'oxygène et le carbone, c'est l'oxygène qui est le plus électronégatif, donc c'est lui qui va attirer les électrons. En plus c'est une double liaison, donc il peut attirer 2 électrons !
L'azote est également plus électronégatif que le carbone, donc il va aussi attirer un électron.
Entre les deux carbones c'est toujours pareil, il ne se passe rien.
Ainsi, le deuxième carbone ''perd'' 2 électrons par sa liaison avec l'oxygène, et 1 électron par sa liaison avec l'azote.
On a donc un oxygène en -II, et un carbone en +III.
L'azote est relié à 2 carbones et à un hydrogène. Il est plus électronégatif que le carbone et l'hydrogène, alors il va attirer un électron pour chaque liaison.
Il sera donc en -III, et l'hydrogène auquel il est relié en +I.
Le dernier carbone est relié à 3 hydrogènes et à un azote.
Il est plus électronégatif que l'hydrogène, alors il attirera à lui un électron par liaison avec un hydrogène (donc 3 au total).
Il est moins électronégatif que l'azote, alors il perdra un électron dans sa liaison avec l'azote.
Au total, il gagne 3 électrons mais en perd 1, il sera donc en -II.
Les hydrogènes auxquels il est relié seront en +I.
Ce qui donne :
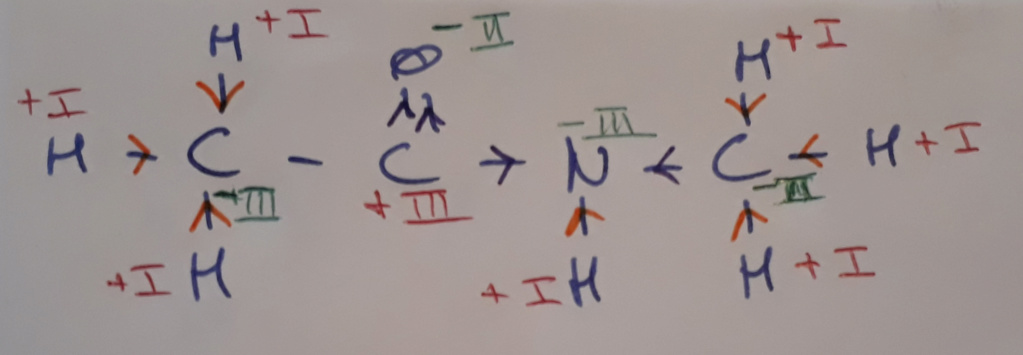
Et si tu fais la somme des nombres d'oxydation de chaque atome, tu obtiens 0, ce qui correspond bien à la charge de la molécule (qui est nulle).
Est-ce que ça te semble plus clair ?

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: TK2 QCM25 nombre d'oxydation
Re: TK2 QCM25 nombre d'oxydation
Waouh merci beaucoup pour cette réponse super claire c'est top 
chouette- Messages : 115
Date d'inscription : 01/11/2017
 Sujets similaires
Sujets similaires» QCM25 Spé Méd
» TK1 qcm25
» Spe med 2011 QCM25
» QCM25 TK3 2017/2018
» Foire aux questions QCM25/29/32 2012
» TK1 qcm25
» Spe med 2011 QCM25
» QCM25 TK3 2017/2018
» Foire aux questions QCM25/29/32 2012
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: CHIMIE GENERALE :: TK & Tutos 2017-2018
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum