Acide/base
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
 Re: Acide/base
Re: Acide/base
Salut !
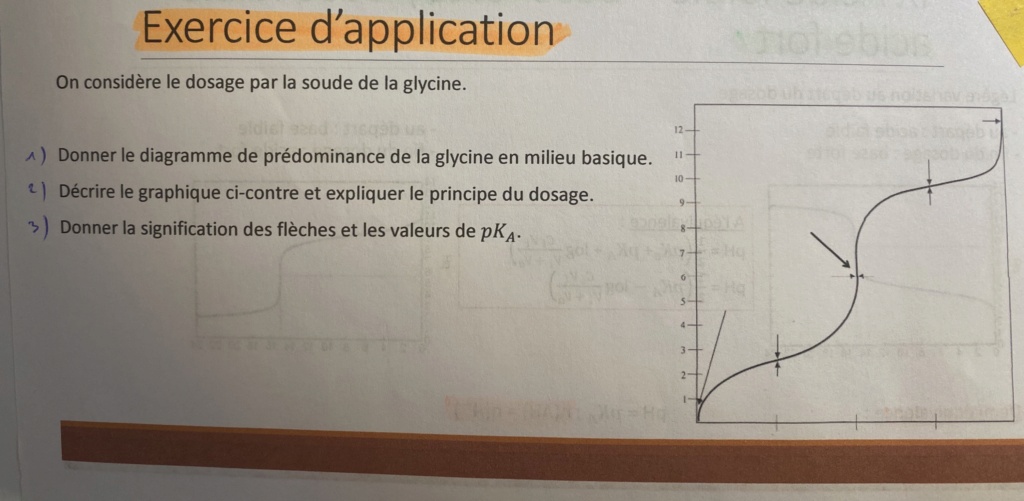
2/ Le dosage correspond à la neutralisation d'une espèce par une autre, le graph représente le graphique d'un diacide par une base forte.
3/ La première flèche (tout en bas) correspond au pH initial, donc au pH mesuré lorsqu'on a pas encore ajouté de base
La double-flèche qui suit correspond à la 1ère demi-équivalence, donc à la demi-équivalence de la première dissociation (l'acide perd un premier proton). Ici pH = pKa1 (pKa de la première dissociation)
La deuxième double-flèche (au milieu) correspond à la 1ère équivalence, donc on a autant d'acide initial que de base et pH = 1/2 × (pKa1 + pKa2)
La troisième double-flèche correspond à la 2e demi-équivalence, donc à la demi-équivalence de la deuxième dissociation (l'acide perd un deuxième proton). Ici pH = pKa2 (pKa de la deuxième dissociation)
La dernière flèche (en haut à droite) correspond à la 2e équivalence
Est-ce que c'est plus clair pour toi ?
2/ Le dosage correspond à la neutralisation d'une espèce par une autre, le graph représente le graphique d'un diacide par une base forte.
3/ La première flèche (tout en bas) correspond au pH initial, donc au pH mesuré lorsqu'on a pas encore ajouté de base
La double-flèche qui suit correspond à la 1ère demi-équivalence, donc à la demi-équivalence de la première dissociation (l'acide perd un premier proton). Ici pH = pKa1 (pKa de la première dissociation)
La deuxième double-flèche (au milieu) correspond à la 1ère équivalence, donc on a autant d'acide initial que de base et pH = 1/2 × (pKa1 + pKa2)
La troisième double-flèche correspond à la 2e demi-équivalence, donc à la demi-équivalence de la deuxième dissociation (l'acide perd un deuxième proton). Ici pH = pKa2 (pKa de la deuxième dissociation)
La dernière flèche (en haut à droite) correspond à la 2e équivalence
Est-ce que c'est plus clair pour toi ?

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
Mat. aime ce message
 Sujets similaires
Sujets similaires» acide/base
» Acide base: Base faible dans l’eau
» Formule pH acide faible / mélange acide faible - base conjuguée
» Acide/ base
» acide/base
» Acide base: Base faible dans l’eau
» Formule pH acide faible / mélange acide faible - base conjuguée
» Acide/ base
» acide/base
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum