Loi de Nerst
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
 Re: Loi de Nerst
Re: Loi de Nerst
Salut !
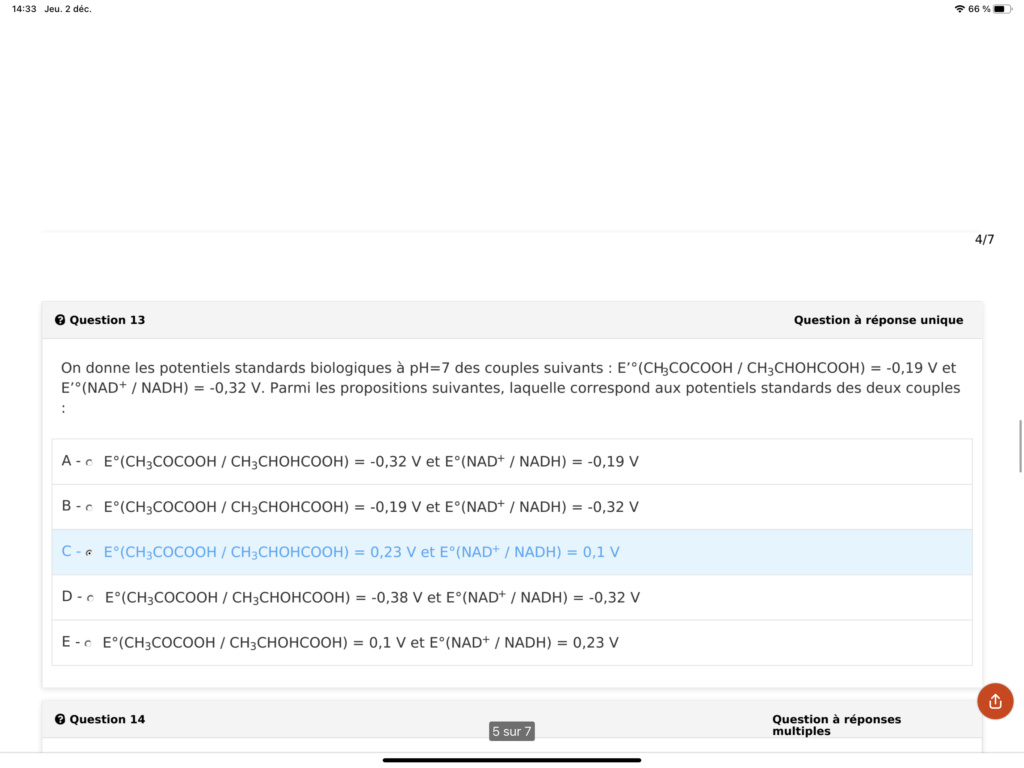
Dans cette question on ne te demande pas d’utiliser l’équation bilan des demi-réactions. Il faut juste reprendre la formule E’° = E° - 0,42 pour retrouver le potentiel standard de tes deux couples. Tu as simplement besoin de faire 2 calculs.
Si on t’avait demander de donner l’équation bilan de ton couple alors là on aurait pris en compte la charge + de la molécule NAD+.
J’espère que ça t’aide
Bon courage !
Dans cette question on ne te demande pas d’utiliser l’équation bilan des demi-réactions. Il faut juste reprendre la formule E’° = E° - 0,42 pour retrouver le potentiel standard de tes deux couples. Tu as simplement besoin de faire 2 calculs.
Si on t’avait demander de donner l’équation bilan de ton couple alors là on aurait pris en compte la charge + de la molécule NAD+.
J’espère que ça t’aide
Bon courage !

Poussin_L- Messages : 32
Date d'inscription : 12/09/2021
Localisation : Archive of our own
Emploi/loisirs : Trouver des memes de chimie
 Equation de Nernst
Equation de Nernst
D’acc super merci bcp ! Mais je ne connaissais pas cette formule, en TD on a utilisé le E’ en faisait l’équation totale et en montrant que E’ = E0 - 0,006/n ph il me semble, est ce que cette formule marche a tous les coup pour calculer le E0 a partir de E’ ?
Merci !!!
Merci !!!
Raphaelle verriele- Messages : 80
Date d'inscription : 14/10/2021
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum