Concours UE1 2014/2015 - Q8
+2
Valentinedrgt
sophie.V
6 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2014-2015
Page 1 sur 1
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
https://docs.google.com/document/d/1cwb1B4hZ1GqIA4Nn6pcj1QMSKrInZxqhg6G7n5LhYZg/edit
salut !
Alors, d'abord en thermochimie on forme un composé à partir de molécules à l'état de corps purs (H2, O2, Cl2 ...). La réponse B est donc correcte.
Pour la proposition D il faut que tu fasses un diagramme de Hess. On te demande la quantité de chaleur échangée entre l'état initial et l'état final pour la réaction : H2 + Cl2 --> 2HCl. Donc tu pars de cette réaction et tu essayes de regarder comment tu peux utiliser les réactions 2, 4 et 5. Ne cherche pas compliquer et n'oublie pas les coefficients multiplicateurs.
Si tu trouves une valeur < 0 : ta réaction est exothermique. Au contraire si elle est >0, elle sera endothermique
Le lien situé au-dessus est le diagramme de Hess : c'est la correction. Essaye de le faire d'abord sans regarder à l'aide de mes indications.
Les réponses exactes sont : BC
pour la proposition C : delta HR1 correspond à la l'entalpie de formation de 2 HCl. Il te suffit donc de diviser cette valeur par 2.
salut !
Alors, d'abord en thermochimie on forme un composé à partir de molécules à l'état de corps purs (H2, O2, Cl2 ...). La réponse B est donc correcte.
Pour la proposition D il faut que tu fasses un diagramme de Hess. On te demande la quantité de chaleur échangée entre l'état initial et l'état final pour la réaction : H2 + Cl2 --> 2HCl. Donc tu pars de cette réaction et tu essayes de regarder comment tu peux utiliser les réactions 2, 4 et 5. Ne cherche pas compliquer et n'oublie pas les coefficients multiplicateurs.
Si tu trouves une valeur < 0 : ta réaction est exothermique. Au contraire si elle est >0, elle sera endothermique
Le lien situé au-dessus est le diagramme de Hess : c'est la correction. Essaye de le faire d'abord sans regarder à l'aide de mes indications.
Les réponses exactes sont : BC
pour la proposition C : delta HR1 correspond à la l'entalpie de formation de 2 HCl. Il te suffit donc de diviser cette valeur par 2.
sophie.V- Messages : 139
Date d'inscription : 27/10/2013
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Ah oui d'accord en fait c'est tout bête !
Merci beaucoup de ton aide !
Merci beaucoup de ton aide !
Valentinedrgt- Messages : 53
Date d'inscription : 06/10/2014
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Bonsoir, je me permets de remonter le sujet ^^
Pour la réponse D, je voulais savoir si c'était normal qu'en appliquant le diagramme de Hess je trouve 185KJ.mol-1 ? (Je n'arrive pas à voir ton lien désolé ^^) ? Je l'ai refait plusieurs fois mais je trouve toujours ce résultat ..
Pour la réponse D, je voulais savoir si c'était normal qu'en appliquant le diagramme de Hess je trouve 185KJ.mol-1 ? (Je n'arrive pas à voir ton lien désolé ^^) ? Je l'ai refait plusieurs fois mais je trouve toujours ce résultat ..
Elo012- Messages : 67
Date d'inscription : 07/10/2014
Age : 27
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Salut !
Normalement on trouve -185, faut bien faire attention au sens de la réaction de R4 et R5 (dans mon souvenir)
Normalement on trouve -185, faut bien faire attention au sens de la réaction de R4 et R5 (dans mon souvenir)
Valentinedrgt- Messages : 53
Date d'inscription : 06/10/2014
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
C'est exactement ça
sophie.V- Messages : 139
Date d'inscription : 27/10/2013
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Dac merci beaucoup 
Elo012- Messages : 67
Date d'inscription : 07/10/2014
Age : 27
 Re question 8
Re question 8
Bonjour,
Je ne comprend pas comment fait-on pour trouver la réponse aux propositions A et B, je ne trouve pas quelle formule il faut utiliser pour pouvoir trouver le sur réponse B, pourriez vous me dire quel est le calcul à faire ?
Merci d'avance
Je ne comprend pas comment fait-on pour trouver la réponse aux propositions A et B, je ne trouve pas quelle formule il faut utiliser pour pouvoir trouver le sur réponse B, pourriez vous me dire quel est le calcul à faire ?
Merci d'avance
V.Dsw- Messages : 91
Date d'inscription : 10/09/2016
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Coucou,
Alors, pour faire la différence entre les propositons A et B il est primordial de savoir qu'une enthalpie de formation se fait à partir de corps simples (H2(g) O2(g), C(graphite) etc). Donc déja DeltaH R2 n'est pas une enthalpie de formation (R1 et R3 oui mais attention pour R1 il faudra penser à diviser par deux car là il y a formation de 2 HCl).
Ensuite pour le calcul il faut que tu partes de la règle de base de la thermo qui est : on s'en balec du chemin parcouru, autrement dit pour la formation du HCl tu as une première réaction à partir des corps simple H2 et CL2 mais il pourrait aussi se produire à partir de H et Cl (mais attention cette fois ce n'est plus une enthalpie standard de formation).
Donc si on représente cela sur un schéma on aura ça : on voit bien qu'il y a plusieurs chemin possible pour la formation du HCl.
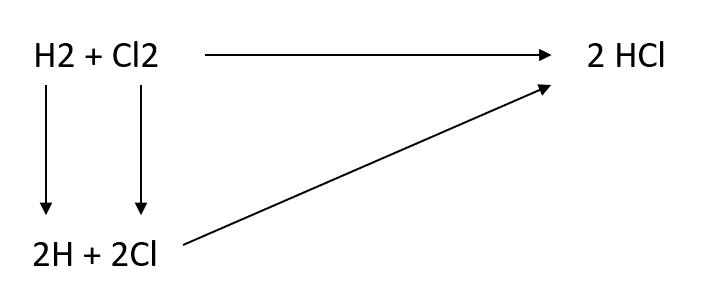
Je te laisse mettre à coté des flèches les DeltaH R correspondant et faire le calcul : pour le calcul il faut donc que tu vérifie si le "chemin du bas" est bien égal à -185.
Si tu as un doute n'hésite pas à nous renvoyer une question
Bon courage
Alors, pour faire la différence entre les propositons A et B il est primordial de savoir qu'une enthalpie de formation se fait à partir de corps simples (H2(g) O2(g), C(graphite) etc). Donc déja DeltaH R2 n'est pas une enthalpie de formation (R1 et R3 oui mais attention pour R1 il faudra penser à diviser par deux car là il y a formation de 2 HCl).
Ensuite pour le calcul il faut que tu partes de la règle de base de la thermo qui est : on s'en balec du chemin parcouru, autrement dit pour la formation du HCl tu as une première réaction à partir des corps simple H2 et CL2 mais il pourrait aussi se produire à partir de H et Cl (mais attention cette fois ce n'est plus une enthalpie standard de formation).
Donc si on représente cela sur un schéma on aura ça : on voit bien qu'il y a plusieurs chemin possible pour la formation du HCl.

Je te laisse mettre à coté des flèches les DeltaH R correspondant et faire le calcul : pour le calcul il faut donc que tu vérifie si le "chemin du bas" est bien égal à -185.
Si tu as un doute n'hésite pas à nous renvoyer une question
Bon courage


La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 question 8
question 8
D'accord merci beaucoup pour cette explication c'est tout bon du coup !
Oui j'avais pas vu qu'il fallait diviser par 2 à la fin le résultat ...
Oui j'avais pas vu qu'il fallait diviser par 2 à la fin le résultat ...
V.Dsw- Messages : 91
Date d'inscription : 10/09/2016
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Salut !! 
Je relance le sujet car j'ai un petit souci. En faisant mon diagramme de Hess, je suis bien parvenue à trouver la réponse B. Cependant, je ne comprends pas pourquoi la proposition C est également juste ... Devons nous la considérer juste simplement parceque elle est aussi égale à -185 ? Pourtant c'est une enthalpie de réaction et de formation ?
Je suis un peu perdue ...
Serait-il possible de m'éclairer ?
Merci beaucoup !!
Je relance le sujet car j'ai un petit souci. En faisant mon diagramme de Hess, je suis bien parvenue à trouver la réponse B. Cependant, je ne comprends pas pourquoi la proposition C est également juste ... Devons nous la considérer juste simplement parceque elle est aussi égale à -185 ? Pourtant c'est une enthalpie de réaction et de formation ?
Je suis un peu perdue ...
Serait-il possible de m'éclairer ?
Merci beaucoup !!

Paullinec- Messages : 80
Date d'inscription : 09/10/2016
 Re: Concours UE1 2014/2015 - Q8
Re: Concours UE1 2014/2015 - Q8
Coucou,
Le passage de H2 + Cl2 à 2 HCl est bien une enthalpie standard de formation sauf qu'on forme 2 HCl, c'est tout simplement le double de la réaction R3.
Donc pour trouver l'enthalpie standard de formation de HCl on peut effectivement passer par cette réaction et diviser le résultat par 2 car ici on forme deux fois la molécule (et on nous demande l'enthalpie de formation d'une seule molécule d'HCl) mais on part bien des corps simples.
Est ce clair ?
Le passage de H2 + Cl2 à 2 HCl est bien une enthalpie standard de formation sauf qu'on forme 2 HCl, c'est tout simplement le double de la réaction R3.
Donc pour trouver l'enthalpie standard de formation de HCl on peut effectivement passer par cette réaction et diviser le résultat par 2 car ici on forme deux fois la molécule (et on nous demande l'enthalpie de formation d'une seule molécule d'HCl) mais on part bien des corps simples.
Est ce clair ?

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Sujets similaires
Sujets similaires» Concours spé med 2012/2013 - Q14 + 2013/2014 - Q20 + 2014/2015 - Q27
» Q9 2014-2015
» Q4 2014 / 2015
» QCM 40 2014/2015
» QCM 20 2014-2015
» Q9 2014-2015
» Q4 2014 / 2015
» QCM 40 2014/2015
» QCM 20 2014-2015
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2014-2015
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum
