Concours UE1 2014/2015 - Q5 et Q7
+5
Koko
sophie.V
Pitchoun'
Margauux
Mamiegali
9 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2014-2015
Page 1 sur 1
 Concours UE1 2014/2015 - Q5 et Q7
Concours UE1 2014/2015 - Q5 et Q7
Saluuut ,
- pour le QCM 5 : soit la molécule ALCL3 susceptible de former la molécule de SiH4
la réponse E dit la géométrique de la molécule est tétraédrique avec des angles de 109,28 c'est faux car la molécule étant AX3E1 n'est pas tétadrique mais pyramide en V ? c'est bien ça ?
De plus elle n'est pas hybridée ?
- pour le QCM 7 on est d'accord que si je diminue la pression, le volume augmente et donc le nombre de mol gazeuses aussi ?
or, la formule est 3/2H2 (g) + 1/2N2 ( g) donne NH3(g) réaction d'entalphie -11KJ donc si je diminue la pression je peux augmenter le rendement soit le nombre de mol de gaz et si je diminue la emeprature j'augmente aussi le rendement , est ce bon?
merci
- pour le QCM 5 : soit la molécule ALCL3 susceptible de former la molécule de SiH4
la réponse E dit la géométrique de la molécule est tétraédrique avec des angles de 109,28 c'est faux car la molécule étant AX3E1 n'est pas tétadrique mais pyramide en V ? c'est bien ça ?
De plus elle n'est pas hybridée ?
- pour le QCM 7 on est d'accord que si je diminue la pression, le volume augmente et donc le nombre de mol gazeuses aussi ?
or, la formule est 3/2H2 (g) + 1/2N2 ( g) donne NH3(g) réaction d'entalphie -11KJ donc si je diminue la pression je peux augmenter le rendement soit le nombre de mol de gaz et si je diminue la emeprature j'augmente aussi le rendement , est ce bon?
merci
Mamiegali- Messages : 84
Date d'inscription : 21/11/2014
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Salut !
Alors allons-y par étape :
Al = 1s² 2s² 2p^6 3s² 3p^1
Cl = 3s² 3p^5
Tu sais que Al peut faire 3 liaisons covalentes : 8- 3 = 5. 3 correspond au nb d'électrons sur la couche de valence. Tu fait 3 liaisons et tu sais que sur ta couche de valence tu as 3 électrons donc tu n'as pas besoin d'ajouter de doubles liaisons. Tu es en AX3 donc ta figure de répulsion est un triangle équilatérale. Tu as 3 liaisons donc ta géométrie correspond à un triangle et ton angle est de 120°.
Tu es obligé d'hybrider ton atome d'aluminium. Pour l'hybridation tu n'utilises que les électrons de la couche de valence de ton atome. En effet, quand tu écris les cases quantiques de l'atome d'aluminium tu as ça :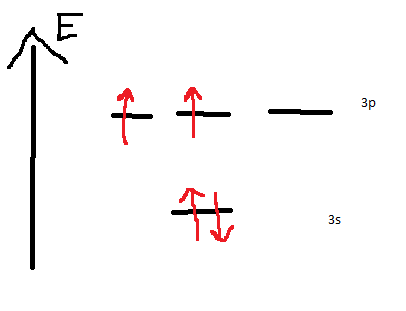
Tu vois donc qu'ici tu ne peux faire qu'une liaison simple avec un Cl. Or, tu veux faire 3 liaisons Cl de même énergie. Un électron s va donc passer en 3p. Ta molécule est donc hybridée sp².
J'espère que c'est plus clair .
.
QCM 7 : quand ta pression diminue, le volume augmente et je vais dans le sens qui augmente le nombre de molécules gazeuses.
Alors si tu diminues la pression tu va dans le sens qui augmente le nombre de molécules gazeuses donc tu vas dans le sens 2. En effet, dans ton équation 3/2H2 (g) + 1/2N2 ( g) donne NH3(g) le sens 1 est celui qui va vers NH3(g). Tu as une molécule de NH3(g) et à gauche de ta flèche tu as en tout 2 molécules gazeuses.
Ta réaction est exothermique dans le sens 1 donc si tu diminues la température, l'équilibre se déplace dans le sens 1 et donc tu augmentes le rendement de NH3 (g).
Alors allons-y par étape :
Al = 1s² 2s² 2p^6 3s² 3p^1
Cl = 3s² 3p^5
Tu sais que Al peut faire 3 liaisons covalentes : 8- 3 = 5. 3 correspond au nb d'électrons sur la couche de valence. Tu fait 3 liaisons et tu sais que sur ta couche de valence tu as 3 électrons donc tu n'as pas besoin d'ajouter de doubles liaisons. Tu es en AX3 donc ta figure de répulsion est un triangle équilatérale. Tu as 3 liaisons donc ta géométrie correspond à un triangle et ton angle est de 120°.
Tu es obligé d'hybrider ton atome d'aluminium. Pour l'hybridation tu n'utilises que les électrons de la couche de valence de ton atome. En effet, quand tu écris les cases quantiques de l'atome d'aluminium tu as ça :

Tu vois donc qu'ici tu ne peux faire qu'une liaison simple avec un Cl. Or, tu veux faire 3 liaisons Cl de même énergie. Un électron s va donc passer en 3p. Ta molécule est donc hybridée sp².
J'espère que c'est plus clair
QCM 7 : quand ta pression diminue, le volume augmente et je vais dans le sens qui augmente le nombre de molécules gazeuses.
Alors si tu diminues la pression tu va dans le sens qui augmente le nombre de molécules gazeuses donc tu vas dans le sens 2. En effet, dans ton équation 3/2H2 (g) + 1/2N2 ( g) donne NH3(g) le sens 1 est celui qui va vers NH3(g). Tu as une molécule de NH3(g) et à gauche de ta flèche tu as en tout 2 molécules gazeuses.
Ta réaction est exothermique dans le sens 1 donc si tu diminues la température, l'équilibre se déplace dans le sens 1 et donc tu augmentes le rendement de NH3 (g).
sophie.V- Messages : 139
Date d'inscription : 27/10/2013
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Sur le schéma il faut que tu supprimes un électron dans la couche 3p
sophie.V- Messages : 139
Date d'inscription : 27/10/2013
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Bonsoir
Comment fait-on pour savoir si exothermique est dans le sens 1 ou 2, de même pour endothermique ?
Car pour moi, exothermique c'est toujours dans le sens 2 (libération d'énergie) et endo toujours dans le sens 1 (capte de l'énergie) ?
Pour la pression j'ai compris mais pour la température je considère toujours que si ma température augmente je vais dans le sens 1 (endo) et si elle baisse dans le sens 2 (exo) , j'ai tord ?
merci d'avance )
)
Comment fait-on pour savoir si exothermique est dans le sens 1 ou 2, de même pour endothermique ?
Car pour moi, exothermique c'est toujours dans le sens 2 (libération d'énergie) et endo toujours dans le sens 1 (capte de l'énergie) ?
Pour la pression j'ai compris mais pour la température je considère toujours que si ma température augmente je vais dans le sens 1 (endo) et si elle baisse dans le sens 2 (exo) , j'ai tord ?
merci d'avance
Margauux- Messages : 23
Date d'inscription : 14/11/2015
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Du coup, faut-il augmenter ou diminuer la pression ? je pense plutôt qu'il faudrait la diminuer, comment fait-on pour savoir ? Jen 'ai pas très bien compris.
Pitchoun'- Messages : 133
Date d'inscription : 06/10/2015
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Coucou, voici une mise au point nécessaire 
prenons une réaction au pif : CO (g) + 1/2O2(g) --> CO2
Je donne delta H°r (delta H° de la réaction) est de -393, 76 kJ.mol-1
delta H°r est négative donc ta réaction est exothermique dans le sens 1. Ta réaction sera donc endothermique dans le sens 2.
A retenir :
delta H° < 0 : exothermique
delta H° > 0 : endothermique
Quand delta H° (de l'énoncé) > 0
Si j'augmente la température je vais me déplacer dans le sens 1
si je diminue la température je me déplace dans le sens 2
Dans notre cas delta H° < 0
si j'augmente la température je me déplace dans le sens 2
si je diminue la température je me déplace dans le sens 1
En ce qui concerne la pression. Je ne prends pas en compte les delta H° mais les molécules de gazs. Quand la pression augmente, je me déplace dans le sens qui diminue les molécules de gazs.
Voilà, j'espère que c'est clair
prenons une réaction au pif : CO (g) + 1/2O2(g) --> CO2
Je donne delta H°r (delta H° de la réaction) est de -393, 76 kJ.mol-1
delta H°r est négative donc ta réaction est exothermique dans le sens 1. Ta réaction sera donc endothermique dans le sens 2.
A retenir :
delta H° < 0 : exothermique
delta H° > 0 : endothermique
Quand delta H° (de l'énoncé) > 0
Si j'augmente la température je vais me déplacer dans le sens 1
si je diminue la température je me déplace dans le sens 2
Dans notre cas delta H° < 0
si j'augmente la température je me déplace dans le sens 2
si je diminue la température je me déplace dans le sens 1
En ce qui concerne la pression. Je ne prends pas en compte les delta H° mais les molécules de gazs. Quand la pression augmente, je me déplace dans le sens qui diminue les molécules de gazs.
Voilà, j'espère que c'est clair
sophie.V- Messages : 139
Date d'inscription : 27/10/2013
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
salut!
j'ai compris que la molécule Al est hybridé sp2 dans la question 5,
mais est ce que la formulation de la proposition C (Al est hybridé 3sp2) est correcte?
j'ai compris que la molécule Al est hybridé sp2 dans la question 5,
mais est ce que la formulation de la proposition C (Al est hybridé 3sp2) est correcte?
Koko- Messages : 24
Date d'inscription : 07/11/2016
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Oui elle est correcte.

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Salut,
J'ai bien lu toutes les réponses mais je ne comprends toujours pas comment l'aluminium peut être hybridé ...
Si j'ai bien suivi, voici sa configuration électronique : Al = 1s² 2s² 2p^6 3s² 3p^1
Comment peut-il être hybridé sp2 alors qu'il n'a qu'un seul électron p sur sa couche de Valence ? Je croyais avoir compris que le "2" indiquait le nombre d'électrons de la couche p hybridés ... Pour moi il serait alors sp ...
Je crois que je n'ai pas compris les bases
Merci d'avance pour votre aide !
J'ai bien lu toutes les réponses mais je ne comprends toujours pas comment l'aluminium peut être hybridé ...
Si j'ai bien suivi, voici sa configuration électronique : Al = 1s² 2s² 2p^6 3s² 3p^1
Comment peut-il être hybridé sp2 alors qu'il n'a qu'un seul électron p sur sa couche de Valence ? Je croyais avoir compris que le "2" indiquait le nombre d'électrons de la couche p hybridés ... Pour moi il serait alors sp ...
Je crois que je n'ai pas compris les bases
Merci d'avance pour votre aide !
Celine.L- Messages : 4
Date d'inscription : 19/09/2017
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Bonjour,
Quand tu hybrides ton atome pour former des liaisons de même niveau d'énergie tu obtiens un électron en s et 2 en p d'où l'hybridation sp2. Il faut que tes électrons soient seuls dans une case quantique pour former une liaison.
Bon courage
Quand tu hybrides ton atome pour former des liaisons de même niveau d'énergie tu obtiens un électron en s et 2 en p d'où l'hybridation sp2. Il faut que tes électrons soient seuls dans une case quantique pour former une liaison.
Bon courage

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Merci pour la réponse !  ça devient plus clair !
ça devient plus clair !
Celine.L- Messages : 4
Date d'inscription : 19/09/2017
 QCM 5 2014-2015 - coplanaire
QCM 5 2014-2015 - coplanaire
Bonsoir 
Pour AlCl3, je ne comprends pas pourquoi la molécule est coplanaire et pas triangulaire...
Pouvez vous m'expliquer le sens de "coplanaire" ?
merci d'avance
Pour AlCl3, je ne comprends pas pourquoi la molécule est coplanaire et pas triangulaire...
Pouvez vous m'expliquer le sens de "coplanaire" ?
merci d'avance
fannochhe- Messages : 77
Date d'inscription : 01/10/2016
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Salut,
Cela veut dire que la molécule est plane ^^
Bon courage
Cela veut dire que la molécule est plane ^^
Bon courage

Raphael18- Messages : 271
Date d'inscription : 20/11/2014
Age : 28
 coplanaire
coplanaire
Re bonsoir 
Comment une molécule peut-elle être plane alors qu'elle a une géométrie triangulaire ?
PS : merci de m'avoir répondu rapidement
Comment une molécule peut-elle être plane alors qu'elle a une géométrie triangulaire ?
PS : merci de m'avoir répondu rapidement
fannochhe- Messages : 77
Date d'inscription : 01/10/2016
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Coucou, un triangle est une figure plane, tous les atomes sont dans un même plan. 

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 coplanaire
coplanaire
Bonsoir 
Mais en revanche, si la molécule étudiée est un tétraèdre, bipyramide trigonale ou un octadèdre, pourrait-elle être coplanaire ?
Mais en revanche, si la molécule étudiée est un tétraèdre, bipyramide trigonale ou un octadèdre, pourrait-elle être coplanaire ?
fannochhe- Messages : 77
Date d'inscription : 01/10/2016
 Re: Concours UE1 2014/2015 - Q5 et Q7
Re: Concours UE1 2014/2015 - Q5 et Q7
Elles ne le sont pas justement ^^ Les atomes se retrouvent dans plus que 2 dimensions de l'espace. Tu ne peux donc pas mettre l'ensemble des atomes dans un même plan.

Raphael18- Messages : 271
Date d'inscription : 20/11/2014
Age : 28
 coplanaire
coplanaire
Merci beaucoup de me répondre si vite 
fannochhe- Messages : 77
Date d'inscription : 01/10/2016
 Sujets similaires
Sujets similaires» Concours spé med 2012/2013 - Q14 + 2013/2014 - Q20 + 2014/2015 - Q27
» QCM 5 (2014-2015)
» ED 2014-2015
» Q16 CC 2014-2015
» 2014-2015 QCM 10
» QCM 5 (2014-2015)
» ED 2014-2015
» Q16 CC 2014-2015
» 2014-2015 QCM 10
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2014-2015
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum