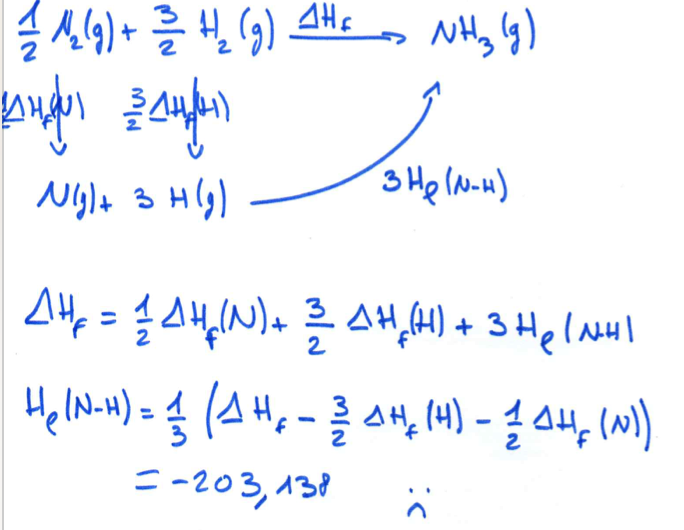Concours UE1 2016/2017 - Q5
+5
coco2
Raphael18
petite8
Sans-Guillaume
zbezbe
9 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2016-2017
Page 1 sur 1

zbezbe- Messages : 214
Date d'inscription : 09/10/2016
Age : 26
Localisation : c'est pas moi qui quitte la P1 c'est la P1 qui me quitte
Emploi/loisirs : Empereur du Sale
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Salut 
Pour moi, tu t'es trompé dans les coefficient des enthalpies de liaisons. On ne forme pas 1/2 N. On forme 1 N.
Idem pour Hf° (H), on en forme 3 et pas 3/2
Après pour faire beaucoup plus simple, ici il n'est pas nécessaire de faire le diagramme de Hess.
Tu pars de l'équation de la réaction qui te permettra de calculer l'enthalpie de liaison :
N (g) + 3 H (g) ---> NH3 (g)
Et tu utilise la formule : H°réaction = Somme des H°formation des produits - Somme des H°formation des réactif
Ce qui te fait 3 x H°liaison N-H = [ H°f(NH3)g ] - [ H°f(N)g + 3 x H°f(H)g ]
 = -46,11 - (472,70 + 3x 217,97)
= -46,11 - (472,70 + 3x 217,97)
 = -46,11 - 1126,61
= -46,11 - 1126,61
 = - 1172,72 kJ/mol
= - 1172,72 kJ/mol
 Il ne faut pas oublier de diviser par 3 pour avoir une seule liaison. Et tu trouves donc - 390,90 kJ/mol
Il ne faut pas oublier de diviser par 3 pour avoir une seule liaison. Et tu trouves donc - 390,90 kJ/mol
A noter qu'une enthalpie de liaison est TOUJOURS négative et qu'une enthalpie de dissociation est TOUJOURS positive.
Sinon ton diagramme de Hess était bon mis à part les coefficients.
Voila, j'espère que ça t'as aider.
Bon courage

Pour moi, tu t'es trompé dans les coefficient des enthalpies de liaisons. On ne forme pas 1/2 N. On forme 1 N.
Idem pour Hf° (H), on en forme 3 et pas 3/2
Après pour faire beaucoup plus simple, ici il n'est pas nécessaire de faire le diagramme de Hess.
Tu pars de l'équation de la réaction qui te permettra de calculer l'enthalpie de liaison :
N (g) + 3 H (g) ---> NH3 (g)
Et tu utilise la formule : H°réaction = Somme des H°formation des produits - Somme des H°formation des réactif
Ce qui te fait 3 x H°liaison N-H = [ H°f(NH3)g ] - [ H°f(N)g + 3 x H°f(H)g ]
A noter qu'une enthalpie de liaison est TOUJOURS négative et qu'une enthalpie de dissociation est TOUJOURS positive.
Sinon ton diagramme de Hess était bon mis à part les coefficients.
Voila, j'espère que ça t'as aider.
Bon courage
Sans-Guillaume- Messages : 46
Date d'inscription : 25/10/2014
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
d'accord ça marche enfaite je vais chercher trop loin 

zbezbe- Messages : 214
Date d'inscription : 09/10/2016
Age : 26
Localisation : c'est pas moi qui quitte la P1 c'est la P1 qui me quitte
Emploi/loisirs : Empereur du Sale
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Salut !
Juste pour etre sure, la proposition E est bien fausse ?
Juste pour etre sure, la proposition E est bien fausse ?
petite8- Messages : 147
Date d'inscription : 19/11/2016
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Oui elle est bien fausse puisque dans le calcule il y a également les énergies de dissociation des réactifs.
Bon courage
Bon courage
Sans-Guillaume- Messages : 46
Date d'inscription : 25/10/2014
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
bonjour, si on part du principe que l'enthalpie de dissociation est toujours positive pourquoi la réponse est négative ?
merci
merci
coco2- Messages : 3
Date d'inscription : 13/11/2017
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Parce qu'ici au final on te demande l'énergie de liaison qui elle est toujours négative !

Raphael18- Messages : 271
Date d'inscription : 20/11/2014
Age : 28
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
coucou,
je relance le sujet car j'ai trouvé le même résultat mais je me pose une question. On sait que une enthalpie de dissociation est toujours positive et une enthalpie de liaison est toujours négative.
De plus dans la question on nous demander l'enthalpie de dissociation qui doit donc être positive. Mais dans les réponses on nous donne les enthalpies de liaisons.. C'est donc la ma question, j'aurai mis la réponse -390 car comme c'est une enthalpie de liaison c'est donc négatif pour moi.
Pouvez vous me dire si mon raisonnement est correct ou non
Merci d'avance et bonne soirée !
je relance le sujet car j'ai trouvé le même résultat mais je me pose une question. On sait que une enthalpie de dissociation est toujours positive et une enthalpie de liaison est toujours négative.
De plus dans la question on nous demander l'enthalpie de dissociation qui doit donc être positive. Mais dans les réponses on nous donne les enthalpies de liaisons.. C'est donc la ma question, j'aurai mis la réponse -390 car comme c'est une enthalpie de liaison c'est donc négatif pour moi.
Pouvez vous me dire si mon raisonnement est correct ou non
Merci d'avance et bonne soirée !
- Messages : 188
Date d'inscription : 25/09/2018
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Salut !
Effectivement, les propositions données sont des enthalpies de liaison, ta réponse devra donc être négative !
Du coup c'est bien la proposition D
Ton raisonnement est correct, continue comme ça !!
Effectivement, les propositions données sont des enthalpies de liaison, ta réponse devra donc être négative !
Du coup c'est bien la proposition D
Ton raisonnement est correct, continue comme ça !!

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Salut !
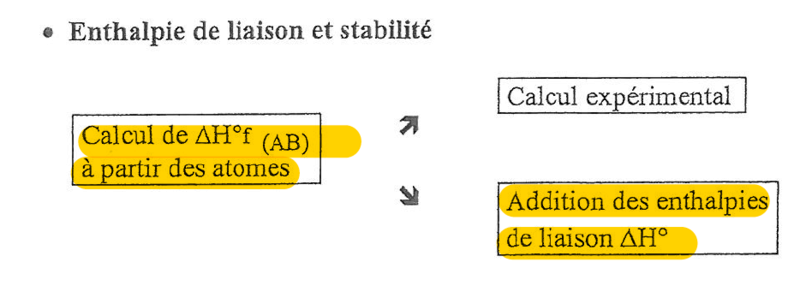
Alors si tu fais la somme des enthalpies de liaison cela te donnera l'enthalpie de synthèse du composé à partir des atomes isolés à l'état gazeux (donc à partir de C(g), H(g), O(g)...)
Ce ne sera pas égale à l'enthalpie de formation qui correspond à l'enthalpie de synthèse du composé à partir des corps simples dans leur état fondamental (donc à partir de H2 (g), C(s), O2 (g)...)
Tu ne pars pas du même état ni du même corps dans les 2 cas donc tu auras besoin d'une énergie différente pour arriver au même résultat
Ce qui est marqué dans le poly c'est que tu peux utiliser l'addition de tes enthalpies de liaison/dissociation pour trouver au final ton enthalpie de formation mais ce n'est pas équivalent !
Je ne sais pas si c'est très clair, en gros tu auras un diagramme de ce type :
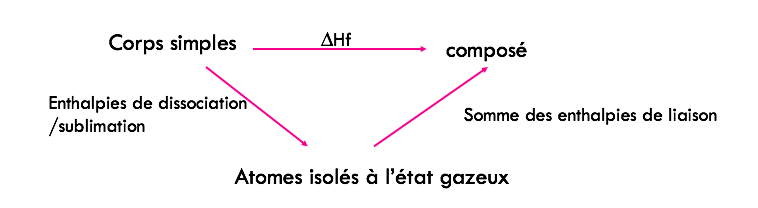
Dis-moi si c'est bon pour toi, bon courage !
Alors si tu fais la somme des enthalpies de liaison cela te donnera l'enthalpie de synthèse du composé à partir des atomes isolés à l'état gazeux (donc à partir de C(g), H(g), O(g)...)
Ce ne sera pas égale à l'enthalpie de formation qui correspond à l'enthalpie de synthèse du composé à partir des corps simples dans leur état fondamental (donc à partir de H2 (g), C(s), O2 (g)...)
Tu ne pars pas du même état ni du même corps dans les 2 cas donc tu auras besoin d'une énergie différente pour arriver au même résultat
Ce qui est marqué dans le poly c'est que tu peux utiliser l'addition de tes enthalpies de liaison/dissociation pour trouver au final ton enthalpie de formation mais ce n'est pas équivalent !
Je ne sais pas si c'est très clair, en gros tu auras un diagramme de ce type :

Dis-moi si c'est bon pour toi, bon courage !
Gabrielle.G- Messages : 179
Date d'inscription : 15/10/2017
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Salut !
Je ne comprend pas pourquoi on nous dit que l'on cherche une énergie de dissociation et que l'on donne les enthalpies des énergies de liaisons. Si c'est liaison c'est sensé être négatif, alors la bonne réponse serait bien la D.
Mais la D est contradictoire avec l'énoncé donc je me perds.
Pouvez-vous me dire si c'est la C ou la D la bonne réponse ?
Merci de votre réponse
Je ne comprend pas pourquoi on nous dit que l'on cherche une énergie de dissociation et que l'on donne les enthalpies des énergies de liaisons. Si c'est liaison c'est sensé être négatif, alors la bonne réponse serait bien la D.
Mais la D est contradictoire avec l'énoncé donc je me perds.
Pouvez-vous me dire si c'est la C ou la D la bonne réponse ?
Merci de votre réponse
poissond'eausalée- Messages : 170
Date d'inscription : 24/11/2018
 Re: Concours UE1 2016/2017 - Q5
Re: Concours UE1 2016/2017 - Q5
Salut !
Effectivement, l'énoncé est mal fait et porte à confusion, mais la bonne proposition est la D : l'enthalpie de liaison (N-H) est bien égale à -390,90
Effectivement, l'énoncé est mal fait et porte à confusion, mais la bonne proposition est la D : l'enthalpie de liaison (N-H) est bien égale à -390,90

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Sujets similaires
Sujets similaires» TK1 UE1 2016/2017 - Q6
» TK2 2016/2017 Q10, Q16, Q19
» QCM 37 2016/2017
» UE2 2016-2017 QCM 15
» TK2 UE1 2016/2017 - Q10 et Q11
» TK2 2016/2017 Q10, Q16, Q19
» QCM 37 2016/2017
» UE2 2016-2017 QCM 15
» TK2 UE1 2016/2017 - Q10 et Q11
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2016-2017
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum