Concours UE1 2016/2017 - Q3
5 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2016-2017
Page 1 sur 1
 Concours UE1 2016/2017 - Q3
Concours UE1 2016/2017 - Q3
Bonjour!!!
En fait je me suis perdue pour cette question...
Si on a un ion comme NO2+, N---->1s2 2s2 2p3 et pour O---> 1s2 2s2 2p3 donc ça fait pour la molécule en tout 16 e- de valence je crois??
A -Mais du coup on retire 1e- à cause de la charge pour le N ou le O?
B- je dirais non il y en a 2 pour chaque Oxygène
C- C'est ce que j'ai trouvé
D- E - Là j'ai le même problème, je sais hybrider mais comment N peut être au milieu de 2 Oxygènes avec des doubles liaisons, du coup il a 4 liaisons au lieu de 3? Je dirais que la E est bonne mais je ne comprends pas comment c'est possible....
J'espere ne pas m'être trop embrouillée dans mes questions...
Merci d'avance!!
En fait je me suis perdue pour cette question...
Si on a un ion comme NO2+, N---->1s2 2s2 2p3 et pour O---> 1s2 2s2 2p3 donc ça fait pour la molécule en tout 16 e- de valence je crois??
A -Mais du coup on retire 1e- à cause de la charge pour le N ou le O?
B- je dirais non il y en a 2 pour chaque Oxygène
C- C'est ce que j'ai trouvé
D- E - Là j'ai le même problème, je sais hybrider mais comment N peut être au milieu de 2 Oxygènes avec des doubles liaisons, du coup il a 4 liaisons au lieu de 3? Je dirais que la E est bonne mais je ne comprends pas comment c'est possible....
J'espere ne pas m'être trop embrouillée dans mes questions...
Merci d'avance!!
pompon- Messages : 169
Date d'inscription : 13/10/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Coucou,
Alors pour établir ta molécule en effet il faut compter les électrons de valence : 2x6 (pour l'O) + 5 (pour le N) - 1 (à cause de la charge) = 16. Donc tu as bien 16 électrons à placer.
Dans la molécule de NO2+ l'azote est l'atome central. Tu place ensuite tes électrons de telle sorte que les valences et l'octet soient respectés. Il y a en effet 4 doublets non liants : 2 sur chaque oxygène.
La formule VSEPR est bien AX2. Ton N est au centre et forme 2 doubles liaisons avec les oxygènes.
Fais attention il n'est dit nul part que le N fait forcément 3 liaisons, que le C fait 4 liaisons etc. Ce qui compte c'est que les valences soient respectées (donc qu'il y ait bien le bon nombre d'électrons de valence autour de l'atome) et que la règle de l'octet soit respectée (qu'il n'y ait pas plus de 8 électrons autour du N en comptant les e- récupérés par les liaisons). Ici ton N a 4 électrons autour de lui (d'ou la charge positive, car sa valence est 5 donc il a perdu un électron) et en récupère 4 autres avec les liaisons (donc l'octet est respecté) c'est donc tout a fait possible
De ce fait comme l'azote forme 2 liaisons sigma et 2 liaisons pi, il est bien hybridé sp.
As tu compris ?
Bon courage
Alors pour établir ta molécule en effet il faut compter les électrons de valence : 2x6 (pour l'O) + 5 (pour le N) - 1 (à cause de la charge) = 16. Donc tu as bien 16 électrons à placer.
Dans la molécule de NO2+ l'azote est l'atome central. Tu place ensuite tes électrons de telle sorte que les valences et l'octet soient respectés. Il y a en effet 4 doublets non liants : 2 sur chaque oxygène.
La formule VSEPR est bien AX2. Ton N est au centre et forme 2 doubles liaisons avec les oxygènes.
Fais attention il n'est dit nul part que le N fait forcément 3 liaisons, que le C fait 4 liaisons etc. Ce qui compte c'est que les valences soient respectées (donc qu'il y ait bien le bon nombre d'électrons de valence autour de l'atome) et que la règle de l'octet soit respectée (qu'il n'y ait pas plus de 8 électrons autour du N en comptant les e- récupérés par les liaisons). Ici ton N a 4 électrons autour de lui (d'ou la charge positive, car sa valence est 5 donc il a perdu un électron) et en récupère 4 autres avec les liaisons (donc l'octet est respecté) c'est donc tout a fait possible
De ce fait comme l'azote forme 2 liaisons sigma et 2 liaisons pi, il est bien hybridé sp.
As tu compris ?
Bon courage


La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Merci pour la réponse!
je crois avoir compris mais donc on dit que la configuration de valence de N est 2s2 2p3 et pour le O c'est 2s2 2p4? pour les ions la configuration ne change pas mais c'est les liaisons qui seront différentes?
Mais si ce n'est pas polyatomique ex: Li+ c'est quand même 1s2 2s1 ou c'est 1s2 ??

je crois avoir compris mais donc on dit que la configuration de valence de N est 2s2 2p3 et pour le O c'est 2s2 2p4? pour les ions la configuration ne change pas mais c'est les liaisons qui seront différentes?
Mais si ce n'est pas polyatomique ex: Li+ c'est quand même 1s2 2s1 ou c'est 1s2 ??
pompon- Messages : 169
Date d'inscription : 13/10/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Non du coup il faut bien enlever l’électron donc pour le NO2+ le N est bien ns2 np2 et dans ton exemple du Li+ sa configuration est donc 1s2.
Désolée si je n'ai pas été très claire dans mon 1er message.
Désolée si je n'ai pas été très claire dans mon 1er message.

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
j'ai compris pour N mais est ce qu'on aurait pu poser la même question pour O? c'est l'atome central qui "subit" la charge ou le O aussi peut perdre un e- sur sa couche de valence?
Non le message est clair je préfère être sure
Non le message est clair je préfère être sure
pompon- Messages : 169
Date d'inscription : 13/10/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Ce qu'il faut bien que tu comprennes c'est que ta molécule est chargée parce que ton N n'a pas es 5 électrons autour de lui donc il est chargé positivement. Tes oxygènes eux ont leur bon nombre d'électrons de valence donc si on demandait il faudrait dire ns2 np4 

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
salut ! Je vais sans doute trop loin  je voulais savoir si Mr Boury fait la distinction entre configuration de valence et fondamental ?
je voulais savoir si Mr Boury fait la distinction entre configuration de valence et fondamental ?
par exemple ici le l'azote qui à la charge positive il est 2s2 2p2 mais est ce qu'il faut pas dire qu'il est plutôt 2s1 2p3 ?
autre exemple avec le carbone : 2s2 2p2 mais s'il est tétraédrique faut il dire qu'il est 2s1 2p3 ?
par exemple ici le l'azote qui à la charge positive il est 2s2 2p2 mais est ce qu'il faut pas dire qu'il est plutôt 2s1 2p3 ?
autre exemple avec le carbone : 2s2 2p2 mais s'il est tétraédrique faut il dire qu'il est 2s1 2p3 ?

zbezbe- Messages : 214
Date d'inscription : 09/10/2016
Age : 26
Localisation : c'est pas moi qui quitte la P1 c'est la P1 qui me quitte
Emploi/loisirs : Empereur du Sale
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
merci !!!!!! j'ai compris!!!!!!!!! 
pompon- Messages : 169
Date d'inscription : 13/10/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
du coup il faut dire que l'azote est 2s2 2p2 ou plutôt 2s1 2p3 ?

zbezbe- Messages : 214
Date d'inscription : 09/10/2016
Age : 26
Localisation : c'est pas moi qui quitte la P1 c'est la P1 qui me quitte
Emploi/loisirs : Empereur du Sale
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Coucou,
Si le Qcm te demande la Valence ou l état fondamental c'est bien 2S2 2p2 (l état fondamental est le plus au niveau d'énergie donc c'est la configuration de base de ton atome, ça ne peut pas être 2S1 2p3)
Sinon c'est son hybridation: sp3
Mais ne t'inquiète pas les qcm sont assez clairs la dessus soit on te demande la Valence ou état fondamental soit on te demande l'hybridation
Bon courage
Si le Qcm te demande la Valence ou l état fondamental c'est bien 2S2 2p2 (l état fondamental est le plus au niveau d'énergie donc c'est la configuration de base de ton atome, ça ne peut pas être 2S1 2p3)
Sinon c'est son hybridation: sp3
Mais ne t'inquiète pas les qcm sont assez clairs la dessus soit on te demande la Valence ou état fondamental soit on te demande l'hybridation
Bon courage

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
d'accord merci beaucoup ! 

zbezbe- Messages : 214
Date d'inscription : 09/10/2016
Age : 26
Localisation : c'est pas moi qui quitte la P1 c'est la P1 qui me quitte
Emploi/loisirs : Empereur du Sale
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Bonjour,
Je reviens sur cette question car je ne comprend pas pourquoi NO2+ est défini par la formule AX2, j'ai trouvé AX2E1...
De plus, je ne comprend pas pourquoi N est hybridé sp...
Merci beaucoup
Je reviens sur cette question car je ne comprend pas pourquoi NO2+ est défini par la formule AX2, j'ai trouvé AX2E1...
De plus, je ne comprend pas pourquoi N est hybridé sp...
Merci beaucoup
nounou- Messages : 42
Date d'inscription : 18/09/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Coucou,
Pour définir la formule VSEPR du NO2+ il faut compter le nombre d'électrons de valence mis en jeu :
- N : 5 e-
- O: 6 e- x2
- Tu enlèves 1e- à cause de la charge positive.
Donc: nb total d'e- = 5 + 6 + 6 - 1 = 16.
Ensuite tu fais une division euclidienne en divisant par 8.
Tu as donc 8/16 = 2 et tu n'as pas de reste ça te fais donc AX2.
La formule du NO2+ est celle-ci et tu vois bien que c'est AX2.
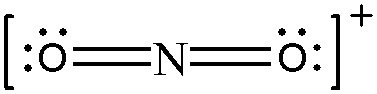
Le N est donc hybridé sp.
Si tu n'as pas vu la méthode de la division euclidienne en tuto pour trouver la formule VSEPR je t'invite à regarder sur mon diapo (Marianne) sur i campus j'ai tout expliqué.
Bon courage
Pour définir la formule VSEPR du NO2+ il faut compter le nombre d'électrons de valence mis en jeu :
- N : 5 e-
- O: 6 e- x2
- Tu enlèves 1e- à cause de la charge positive.
Donc: nb total d'e- = 5 + 6 + 6 - 1 = 16.
Ensuite tu fais une division euclidienne en divisant par 8.
Tu as donc 8/16 = 2 et tu n'as pas de reste ça te fais donc AX2.
La formule du NO2+ est celle-ci et tu vois bien que c'est AX2.
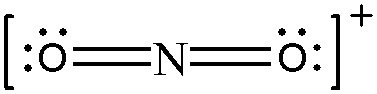
Le N est donc hybridé sp.
Si tu n'as pas vu la méthode de la division euclidienne en tuto pour trouver la formule VSEPR je t'invite à regarder sur mon diapo (Marianne) sur i campus j'ai tout expliqué.
Bon courage


La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Oui d'accord ! Merci beaucoup !
nounou- Messages : 42
Date d'inscription : 18/09/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Yo,
Mais du coup ce que je comprend pas pour cette question c'est qu'on trouve AX2 donc il y a 2 liaisons dans la molécule (en l'occurrence 2 liaisons doubles) mais il y a également 4 doublets. Pourquoi ne sont-ils pas représenté sur la formule AX2 ? Est ce que c'est parce que les doublets non liants de cette formule correspondent à ceux de l'atome central ?
Aussi est ce que la réponse "N engage 2 liaisons Pi" est vrai ? car N engage bien 2 liaisons pi mais également 2 liaisons sigma du coup, la réponse est partielle. Doit-on la considérer comme vraie ?
J'ai un autre exemple que je comprend pas, c'est la molécule AlCl3. Quand on compte les electrons de valence de Cl et de Al et qu'on les placent sur la molécule, on trouve que Al possède trois liaisons simples avec Cl et vu qu'on voit que la regle de l'octet n'est pas respectée pour Al on rajoute un doublet non liant. Maiss j'ai voulu vérifier en calculant VSEPR et on trouve 10e en tout pour la molécule ce qui nous donne AX1E1. Or Al ne fait pas qu'une seule liaison...
Merci

Mais du coup ce que je comprend pas pour cette question c'est qu'on trouve AX2 donc il y a 2 liaisons dans la molécule (en l'occurrence 2 liaisons doubles) mais il y a également 4 doublets. Pourquoi ne sont-ils pas représenté sur la formule AX2 ? Est ce que c'est parce que les doublets non liants de cette formule correspondent à ceux de l'atome central ?
Aussi est ce que la réponse "N engage 2 liaisons Pi" est vrai ? car N engage bien 2 liaisons pi mais également 2 liaisons sigma du coup, la réponse est partielle. Doit-on la considérer comme vraie ?
J'ai un autre exemple que je comprend pas, c'est la molécule AlCl3. Quand on compte les electrons de valence de Cl et de Al et qu'on les placent sur la molécule, on trouve que Al possède trois liaisons simples avec Cl et vu qu'on voit que la regle de l'octet n'est pas respectée pour Al on rajoute un doublet non liant. Maiss j'ai voulu vérifier en calculant VSEPR et on trouve 10e en tout pour la molécule ce qui nous donne AX1E1. Or Al ne fait pas qu'une seule liaison...
Merci

poissond'eaudouce <3- Messages : 348
Date d'inscription : 08/10/2017
 Re: Concours UE1 2016/2017 - Q3
Re: Concours UE1 2016/2017 - Q3
Coucou,
Attention dans la formule VSEPR on se concentre sur l'atome central. Quand on dit AX2 cela signifie que l'atome central fait 2 liaisons et n'a pas de doublets.
La proposition est vraie, elle aurait été fausse s'il y avait écrit par exemple : engage uniquement 2 liaisons pi.
Je sais que le QCM c'est parfois vicieux mais ne cherchez pas les pièges partout
ATTENTION: on ne rajoute pas de doublet non liant mais une CASE VACANTE si l'octet n'est pas respecté. Si tu calcules, tu as 7x3 (pour les 3 Cl) + 3 (pour Al) = 21 + 3 = 24
24 / 8 = 3 donc AX3.
Fais attention de bien compté le bon nombre d'électrons de valence. Ici tu as trois atomes de Cl donc on compte 7e- fois 3.
Pour rappel :
* les charges + et - concernent la valence de l'atome, si un atome a 1e- en plus de sa valence il est chargé négativement, s'il a un atome en moins par rapport à sa valence il est chargé positivement .
* la case quantique signifie qu'il y a une orbitale vide donc que l'octet n'est pas respecté.
Bon courage
Attention dans la formule VSEPR on se concentre sur l'atome central. Quand on dit AX2 cela signifie que l'atome central fait 2 liaisons et n'a pas de doublets.
La proposition est vraie, elle aurait été fausse s'il y avait écrit par exemple : engage uniquement 2 liaisons pi.
Je sais que le QCM c'est parfois vicieux mais ne cherchez pas les pièges partout
ATTENTION: on ne rajoute pas de doublet non liant mais une CASE VACANTE si l'octet n'est pas respecté. Si tu calcules, tu as 7x3 (pour les 3 Cl) + 3 (pour Al) = 21 + 3 = 24
24 / 8 = 3 donc AX3.
Fais attention de bien compté le bon nombre d'électrons de valence. Ici tu as trois atomes de Cl donc on compte 7e- fois 3.
Pour rappel :
* les charges + et - concernent la valence de l'atome, si un atome a 1e- en plus de sa valence il est chargé négativement, s'il a un atome en moins par rapport à sa valence il est chargé positivement .
* la case quantique signifie qu'il y a une orbitale vide donc que l'octet n'est pas respecté.
Bon courage

La Gueuse- Messages : 293
Date d'inscription : 07/12/2014
 Sujets similaires
Sujets similaires» TK1 UE1 2016/2017 - Q6
» TK2 2016/2017 Q10, Q16, Q19
» QCM 37 2016/2017
» UE2 2016-2017 QCM 15
» TK2 UE1 2016/2017 - Q10 et Q11
» TK2 2016/2017 Q10, Q16, Q19
» QCM 37 2016/2017
» UE2 2016-2017 QCM 15
» TK2 UE1 2016/2017 - Q10 et Q11
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2016-2017
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum