Isobare et isochore
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
 Isobare et isochore
Isobare et isochore
Bonjour,
Dans le cours de Boury, en chimie G il y a une partie sur l'enthalpie où il est écrit :
"pression et volume varient rarement simultanément
à volume constant => transformation isochore
à pression constante => transformation isobare"
Je ne comprends pas pourquoi le volume et la pression ne varient pas ensemble ?
Par exemple, avec une même quantité de matière, PV = constante donc si P augmente V diminue et inversement donc je sui sun peu perdue
Merci d'avance
Dans le cours de Boury, en chimie G il y a une partie sur l'enthalpie où il est écrit :
"pression et volume varient rarement simultanément
à volume constant => transformation isochore
à pression constante => transformation isobare"
Je ne comprends pas pourquoi le volume et la pression ne varient pas ensemble ?

Par exemple, avec une même quantité de matière, PV = constante donc si P augmente V diminue et inversement donc je sui sun peu perdue
Merci d'avance

Brutus- Admin
- Messages : 319
Date d'inscription : 29/11/2017
Age : 24
Localisation : Déni
Emploi/loisirs : Rouler sur les gens
 Re: Isobare et isochore
Re: Isobare et isochore
Salut,
Quand Boury dit que la pression et le volume varie rarement simultanément, il parle de a pression et du volume du système globale. Par exemple dans une équation qui se déroule à l'état standard, e volume peut varier mais la pression reste la pression atmosphèrique : il parle bien de la pression et du volume du milieu dans lequel la réaction se déroule.
Dans l'équation PV=nRT on ne prend plus en compte la pression du milieu mais il s'agit de pression partielle, c'est à dire la pression propre qu'exercerait le gaz en question s'il était tout seul dans le volume V.
De plus fait attention, lorsque la concentration évolue, il y a aussi la température T qui peut être modifiée (l'autre côté de la réaction) et pas seulement P et V.
J'espère t'avoir éclairée !
Bon courage
Quand Boury dit que la pression et le volume varie rarement simultanément, il parle de a pression et du volume du système globale. Par exemple dans une équation qui se déroule à l'état standard, e volume peut varier mais la pression reste la pression atmosphèrique : il parle bien de la pression et du volume du milieu dans lequel la réaction se déroule.
Dans l'équation PV=nRT on ne prend plus en compte la pression du milieu mais il s'agit de pression partielle, c'est à dire la pression propre qu'exercerait le gaz en question s'il était tout seul dans le volume V.
De plus fait attention, lorsque la concentration évolue, il y a aussi la température T qui peut être modifiée (l'autre côté de la réaction) et pas seulement P et V.
J'espère t'avoir éclairée !
Bon courage
Lenouch- Messages : 136
Date d'inscription : 07/02/2017
Age : 26
 Re: Isobare et isochore
Re: Isobare et isochore
Salut,
oui merci c'est un peu plus clair !
Est-ce que quand la concentration varie la température change forcément ? Est-ce que c'est exactement ça qui est représenté par
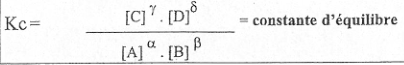
J'ai un peu de mal à comprendre ce que veulent dire ces K... est-ce que c'est lié au changement de température uniquement ?
MErci d'avance !
oui merci c'est un peu plus clair !
Est-ce que quand la concentration varie la température change forcément ? Est-ce que c'est exactement ça qui est représenté par
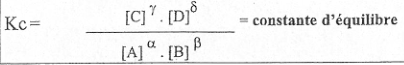
J'ai un peu de mal à comprendre ce que veulent dire ces K... est-ce que c'est lié au changement de température uniquement ?
MErci d'avance !

Brutus- Admin
- Messages : 319
Date d'inscription : 29/11/2017
Age : 24
Localisation : Déni
Emploi/loisirs : Rouler sur les gens
 Re: Isobare et isochore
Re: Isobare et isochore
Salut,
Je comprends tes doutes, ces notions sont un peu compliqués pour tout le monde.
Kc est en fait une constante à une température donnée qui permet de définir le rapport entre les concentrations des réactifs et des produits à l'état l'équilibre.
C'est à dire que à partir de la formule
on déduit que quelque soit la concentration de [C] ou de [D] ect.. ce rapport sera toujours le même pour la température donnée à l'état d'équilibre.
Cela te permet dans un exercice par exemple, de trouver la concentration d'un composée à l'équilibre si l'on te donne le Kc et les 3 autres concentrations.
Ensuite, un peu plus loin, le prof parle du Kp, il s'agit du même principe mais appliqué aux pressions partielles. Donc Kp ne correspond plus au rapport des concentrations mais au rapport des pressions, et définie donc une deuxième constante, qui est toujours valable à l'équilibre et pour une température donnée.
Du coup pour répondre à ta question : Kp et Kc sont liés au changement de température uniquement.
En plus de te permette de calculer des concentrations et des pressions, ces valeurs de Kp et de Kc indiquent l'équilibre de la réaction.
En fait dès que la réaction change d'équilibre, cela se fait soit dans le sens exothermique donc la température augmente (car réaction libère de l'énergie) soit dans le sens endothermique donc la température diminue (car la réaction absorbe l'énergie). Et à chaque fois le Kc et Kp sont modifiés en parallèle.
Il faut se dire que la température représente en quelque sorte la quantité d'énergie présente dans le milieu.
Ma réponse et un peu longue, mais j'espère qu'elle te sera utile, désolée d'avoir répondu un peu tard.
N'hésite pas à poser d'autres questions ou à insister sur des points pas encore clairs
Je comprends tes doutes, ces notions sont un peu compliqués pour tout le monde.
Kc est en fait une constante à une température donnée qui permet de définir le rapport entre les concentrations des réactifs et des produits à l'état l'équilibre.
C'est à dire que à partir de la formule

on déduit que quelque soit la concentration de [C] ou de [D] ect.. ce rapport sera toujours le même pour la température donnée à l'état d'équilibre.
Cela te permet dans un exercice par exemple, de trouver la concentration d'un composée à l'équilibre si l'on te donne le Kc et les 3 autres concentrations.
Ensuite, un peu plus loin, le prof parle du Kp, il s'agit du même principe mais appliqué aux pressions partielles. Donc Kp ne correspond plus au rapport des concentrations mais au rapport des pressions, et définie donc une deuxième constante, qui est toujours valable à l'équilibre et pour une température donnée.
Du coup pour répondre à ta question : Kp et Kc sont liés au changement de température uniquement.
En plus de te permette de calculer des concentrations et des pressions, ces valeurs de Kp et de Kc indiquent l'équilibre de la réaction.
En fait dès que la réaction change d'équilibre, cela se fait soit dans le sens exothermique donc la température augmente (car réaction libère de l'énergie) soit dans le sens endothermique donc la température diminue (car la réaction absorbe l'énergie). Et à chaque fois le Kc et Kp sont modifiés en parallèle.
Il faut se dire que la température représente en quelque sorte la quantité d'énergie présente dans le milieu.
Ma réponse et un peu longue, mais j'espère qu'elle te sera utile, désolée d'avoir répondu un peu tard.
N'hésite pas à poser d'autres questions ou à insister sur des points pas encore clairs
Lenouch- Messages : 136
Date d'inscription : 07/02/2017
Age : 26
 Re: Isobare et isochore
Re: Isobare et isochore
Merci beaucoup ! Tout est plus clair 


Brutus- Admin
- Messages : 319
Date d'inscription : 29/11/2017
Age : 24
Localisation : Déni
Emploi/loisirs : Rouler sur les gens
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum