nombre quantique
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
 nombre quantique
nombre quantique
Bonjour, j'ai beau regarder, je ne sais pas comment calculer les nombres quantique..
Je sais que n est le nombre de couche mais pour le nombre quantique azimutal, la case quantique et le spin je n'y arrive pas, pourriez vous m'aider avec un exemple ?
Je sais que n est le nombre de couche mais pour le nombre quantique azimutal, la case quantique et le spin je n'y arrive pas, pourriez vous m'aider avec un exemple ?
Elisebtd- Messages : 13
Date d'inscription : 12/11/2018
 Re: nombre quantique
Re: nombre quantique
Salut !
Il existe 4 nombres quantiques, qui servent à décrire un électron particulier dans le nuage électronique de l'atome. C'est un peu comme une "adresse" pour ton électron !
Donc tu pars du pars du plus général pour aller vers le plus précis (comme pour une adresse, tu es dans pays, dans une ville, dans une rue, etc.)
Le premier nombre quantique c'est n (nombre quantique principal), qui correspond à la couche sur laquelle est situé ton électron.
n est un nombre entier supérieur à 0 (1, 2, 3, 4...)
Le deuxième c'est l (nombre quantique azimutal), qui correspond à la sous-couche sur laquelle est situé ton électron (s, p, d, f).
Chaque sous-couche est associée à un nombre : s = 0 ; p = 1 ; d = 2 ; f = 3
Donc l sera égal à 0, 1, 2 ou 3
Le troisième c'est m (nombre quantique magnétique), qui correspond à la case quantique dans laquelle est situé ton électron.
Le nombre de cases quantiques dépend de la sous-couche (1 pour s, 3 pour p, 5 pour d, 7 pour f), et les cases sont numérotées de -l à +l
Le quatrième c'est spin, qui correspond au sens de rotation de ton électron, il sera égal à +1/2 ou à -1/2, sachant que dans chaque case quantique tu peux mettre 2 électrons de spin opposé.
Pour essayer de rendre tout ça un peu plus concret, voici un exemple :
On prend le vanadium, de numéro atomique 23, et on te demande de retrouver l'électron caractérisé par les nombres quantiques suivants :
n = 3
l = 1
m = -1
spin = 1/2
Pour retrouver ton électron, tu commences par remplir tes couches électroniques selon la règle de Klechkowski
1s2
2s2 2p6
3s2 3p6 3d3
4s2
Tu sais que n=3, donc ton électron se trouve sur la 3e couche électronique :
1s2
2s2 2p6
3s2 3p6 3d3
4s2
Tu sais que l=1, ce qui correspond à la sous-couche p :
1s2
2s2 2p6
3s2 3p6 3d3
4s2
Maintenant on passe aux cases quantiques, qui ne sont pas visibles sur la représentation de la couche électronique. Du coup, on va dessiner nos cases quantiques.
On est sur une sous-couche p, qui comprend donc 6 électrons. Sachant qu'on met 2 électrons par case quantique, on aura besoin de 3 cases quantiques pour loger nos 6 électrons.

Ensuite, tu sais que m est compris entre -l et l. Ici, l = 1, donc -1 < m < 1
Comme m est un nombre entier, il pourra être égal à -1, 0 ou 1
Tu peux donc nommer tes cases quantiques :
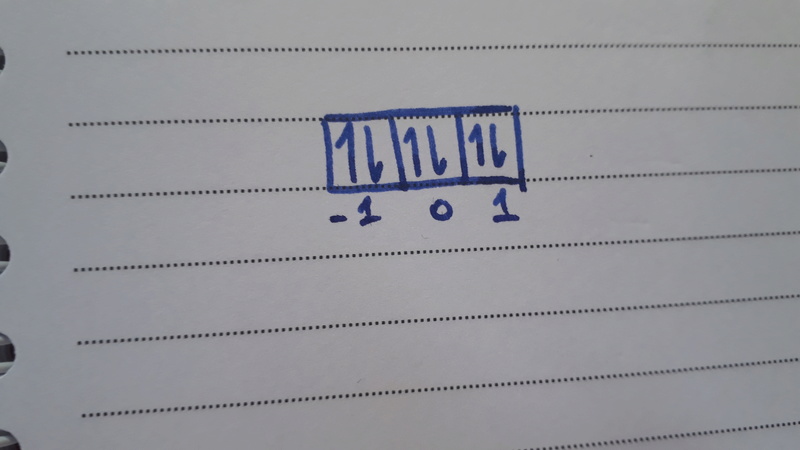
Ici on te dit que m = -1, donc ton électron se situe dans la première case quantique.
Enfin, on te donne spin = 1/2, donc ton électron pointe vers le haut, c'est donc celui-ci :
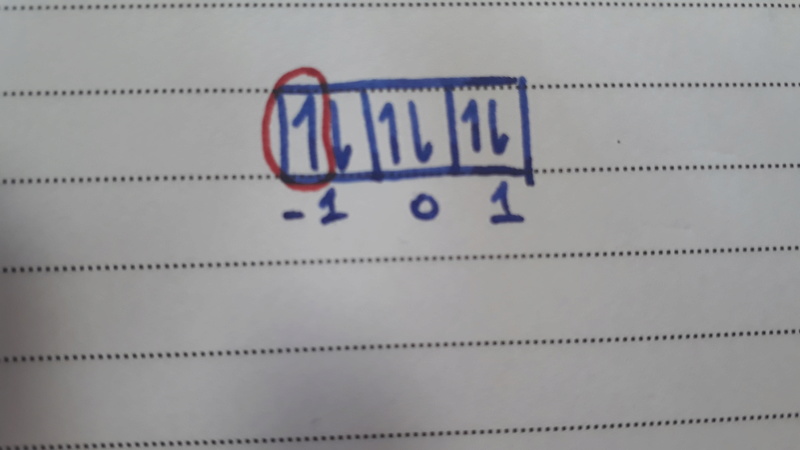
Voilà, j'espère que c'est désormais plus clair pour toi, dis moi si tu as encore des questions !
Il existe 4 nombres quantiques, qui servent à décrire un électron particulier dans le nuage électronique de l'atome. C'est un peu comme une "adresse" pour ton électron !
Donc tu pars du pars du plus général pour aller vers le plus précis (comme pour une adresse, tu es dans pays, dans une ville, dans une rue, etc.)
Le premier nombre quantique c'est n (nombre quantique principal), qui correspond à la couche sur laquelle est situé ton électron.
n est un nombre entier supérieur à 0 (1, 2, 3, 4...)
Le deuxième c'est l (nombre quantique azimutal), qui correspond à la sous-couche sur laquelle est situé ton électron (s, p, d, f).
Chaque sous-couche est associée à un nombre : s = 0 ; p = 1 ; d = 2 ; f = 3
Donc l sera égal à 0, 1, 2 ou 3
Le troisième c'est m (nombre quantique magnétique), qui correspond à la case quantique dans laquelle est situé ton électron.
Le nombre de cases quantiques dépend de la sous-couche (1 pour s, 3 pour p, 5 pour d, 7 pour f), et les cases sont numérotées de -l à +l
Le quatrième c'est spin, qui correspond au sens de rotation de ton électron, il sera égal à +1/2 ou à -1/2, sachant que dans chaque case quantique tu peux mettre 2 électrons de spin opposé.
Pour essayer de rendre tout ça un peu plus concret, voici un exemple :
On prend le vanadium, de numéro atomique 23, et on te demande de retrouver l'électron caractérisé par les nombres quantiques suivants :
n = 3
l = 1
m = -1
spin = 1/2
Pour retrouver ton électron, tu commences par remplir tes couches électroniques selon la règle de Klechkowski
1s2
2s2 2p6
3s2 3p6 3d3
4s2
Tu sais que n=3, donc ton électron se trouve sur la 3e couche électronique :
1s2
2s2 2p6
3s2 3p6 3d3
4s2
Tu sais que l=1, ce qui correspond à la sous-couche p :
1s2
2s2 2p6
3s2 3p6 3d3
4s2
Maintenant on passe aux cases quantiques, qui ne sont pas visibles sur la représentation de la couche électronique. Du coup, on va dessiner nos cases quantiques.
On est sur une sous-couche p, qui comprend donc 6 électrons. Sachant qu'on met 2 électrons par case quantique, on aura besoin de 3 cases quantiques pour loger nos 6 électrons.

Ensuite, tu sais que m est compris entre -l et l. Ici, l = 1, donc -1 < m < 1
Comme m est un nombre entier, il pourra être égal à -1, 0 ou 1
Tu peux donc nommer tes cases quantiques :
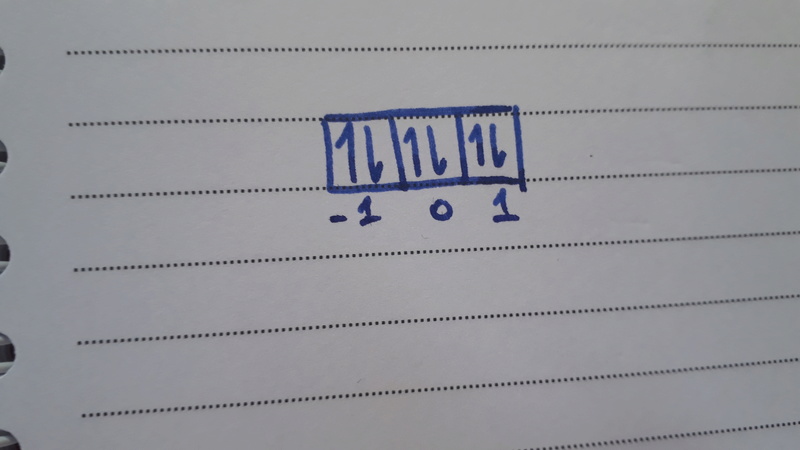
Ici on te dit que m = -1, donc ton électron se situe dans la première case quantique.
Enfin, on te donne spin = 1/2, donc ton électron pointe vers le haut, c'est donc celui-ci :

Voilà, j'espère que c'est désormais plus clair pour toi, dis moi si tu as encore des questions !

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: nombre quantique
Re: nombre quantique
j'ai compris ! Merci beaucoup !
Elisebtd- Messages : 13
Date d'inscription : 12/11/2018
 Sujets similaires
Sujets similaires» Banque de QCM : nombre quantique
» Nombre quantique magnétique
» On peut douter de tout mais pas de sa Volkswagen
» Processus quantique de la Diffusion Raman
» Nombre d'oxydation
» Nombre quantique magnétique
» On peut douter de tout mais pas de sa Volkswagen
» Processus quantique de la Diffusion Raman
» Nombre d'oxydation
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum