QCM 7 tk 1
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Biophysique :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: TK & Tutos 2018-2019
Page 1 sur 1
 QCM 7 tk 1
QCM 7 tk 1
Hello
Je ne comprend pas pourquoi on utilise directement la formule de la base faible pour calculer le pH du mélange A. Ce n'est pas parce que on mélange une base faible avec de l'eau que le mélange sera composé de base faible ?
Par ailleurs en faisant le tableau d'avancement, puisque la réaction est limité (la base étant faible au vu de son pkA) on retrouve a la fin de l'acide et du HO- (base forte) donc je ne comprend pas votre raisonnement
Finalement dans la solution pour calculer le pH final on utilise la formule pH = 1/2 (pka1 +pka2)
Seulement je pensais que cette formule n'était applicable que lorsque nous sommes en présence d'amphotere
Je vous joint ci dessous mon tableau et l'énoncé
Merci !
url=https://servimg.com/view/19810136/69]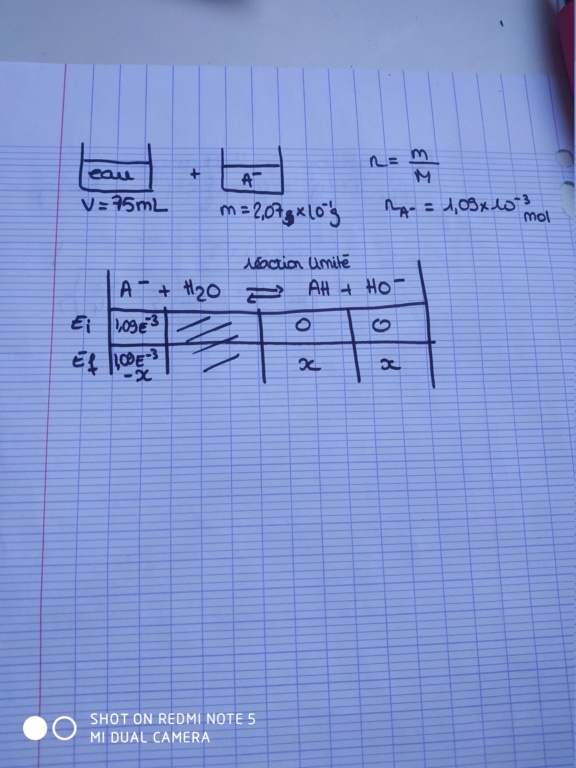 [/url]
[/url]

Je ne comprend pas pourquoi on utilise directement la formule de la base faible pour calculer le pH du mélange A. Ce n'est pas parce que on mélange une base faible avec de l'eau que le mélange sera composé de base faible ?
Par ailleurs en faisant le tableau d'avancement, puisque la réaction est limité (la base étant faible au vu de son pkA) on retrouve a la fin de l'acide et du HO- (base forte) donc je ne comprend pas votre raisonnement
Finalement dans la solution pour calculer le pH final on utilise la formule pH = 1/2 (pka1 +pka2)
Seulement je pensais que cette formule n'était applicable que lorsque nous sommes en présence d'amphotere
Je vous joint ci dessous mon tableau et l'énoncé
Merci !
url=https://servimg.com/view/19810136/69]
 [/url]
[/url]

poissond'eaudouce <3- Messages : 348
Date d'inscription : 08/10/2017
 Re: QCM 7 tk 1
Re: QCM 7 tk 1
Il fallait juste comprendre ici que :
On te donne citron = C6H5O73- = partie du couple qui est la base + pKa = 4,2 donc base faible - il ne fallait pas se torturer l'esprit.
+ la formule est utilisable dans ce cas car on ajoute base faible et acide faible.
Je te mets en lien l'exercice dont il est tiré avec la correction.
http://exercicesdechimie.fr/PACES-rennes/Acides-bases/50587
Voilà désolé du retard <3
Bisous
On te donne citron = C6H5O73- = partie du couple qui est la base + pKa = 4,2 donc base faible - il ne fallait pas se torturer l'esprit.
+ la formule est utilisable dans ce cas car on ajoute base faible et acide faible.
Je te mets en lien l'exercice dont il est tiré avec la correction.
http://exercicesdechimie.fr/PACES-rennes/Acides-bases/50587
Voilà désolé du retard <3
Bisous
ChloéJ- Messages : 46
Date d'inscription : 03/11/2017
Tutorat Licence Santé Lille Catho :: L1 - Biophysique :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: TK & Tutos 2018-2019
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum