Lewis ClO-4
+2
Albatar
Asticoo
6 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
 Lewis ClO-4
Lewis ClO-4
heyy,
je ne comprends pas tout comment faire la structure du Lewis pour le ClO4- ... j'ai fait la méthode de Gautret, mais je coince... j'ai compté mes éléctrons, il faut que j'en place 26, et donc j'ai commencé par faire que le Cl fasse une liaison avec chaque O, et donc je me retrouve avec 18 électrons.
je les place d'abord sur le Cl vu que c'est le plus électronégatif, sauf que vu qu'il fait déjà 4 liaisons simples la règle de l'octet est déjà respecté, et après je les place sur les O, et la je bloque...
j'ai divisé 18 par 4 et donc je me suis dit que pour 2 O ils auront 5 électrons (+ceux de la liaison simple avec le Cl du début), et 2 autres O en auront 4 électrons (+ceux de la liaison simple).
Et donc pour ceux qui ne respectent pas l'octet je mets des liaisons doubles, donc pour les O avec 4 éléctrons + 2 électrons de la liaison simple je crée une liaison double?? et pour ceux avec 5 électrons??
enfin voila je suis vraiment perdue...
si vous pourriez m'expliquer ca serait génial,
merci beaucoup!
je ne comprends pas tout comment faire la structure du Lewis pour le ClO4- ... j'ai fait la méthode de Gautret, mais je coince... j'ai compté mes éléctrons, il faut que j'en place 26, et donc j'ai commencé par faire que le Cl fasse une liaison avec chaque O, et donc je me retrouve avec 18 électrons.
je les place d'abord sur le Cl vu que c'est le plus électronégatif, sauf que vu qu'il fait déjà 4 liaisons simples la règle de l'octet est déjà respecté, et après je les place sur les O, et la je bloque...
j'ai divisé 18 par 4 et donc je me suis dit que pour 2 O ils auront 5 électrons (+ceux de la liaison simple avec le Cl du début), et 2 autres O en auront 4 électrons (+ceux de la liaison simple).
Et donc pour ceux qui ne respectent pas l'octet je mets des liaisons doubles, donc pour les O avec 4 éléctrons + 2 électrons de la liaison simple je crée une liaison double?? et pour ceux avec 5 électrons??
enfin voila je suis vraiment perdue...
si vous pourriez m'expliquer ca serait génial,
merci beaucoup!
budapest- Messages : 52
Date d'inscription : 15/10/2018
 Re: Lewis ClO-4
Re: Lewis ClO-4
Salut !
Effectivement, on commence par compter les électrons impliqués :
Cl : Z = 17 -> 1s2 2s2 2p6 3s2 3s5 la couche de valence comprend 7 électrons
O : Z =8 -> 1s2 2s2 2p4 donc la couche de valence comprend 6 électrons
Si on fait le total, on a 1 Cl + 4 O + une charge négative = 1 × 7 + 4 × 6 + 1 = 32 électrons
On commence par placer le chlore au centre, entouré de ses 7 électrons.
Autour de lui, on place les 4 oxygènes, auxquels on attribue leurs 6 électrons respectifs.
Il nous manque donc l'électron supplémentaire de la charge négative, mais on le placera ultérieurement.
Avec cette configuration, tu remarques que tu peux effectuer 3 doubles liaisons Cl=O + 1 liaison simple Cl-O.
De cette façon, tous les électrons du chlore sont mobilisés !
Ensuite, avec les électrons restant sur les oxygènes, tu formes des doublets non-liant : sur les 3 oxygènes directement liés au chlore, on forme deux doublets non-liants.
Reste l'oxygène à simple liaison, pour lequel on a 2 doublets + 1 électron célibataire : c'est donc ici qu'on ajoutera notre électron supplémentaire ! Étant donné qu'il sera entouré de 7 électrons (1 simple liaison + 3 doublets non-liants), il portera donc la charge négative de la molécule.
Est-ce que c'est plus clair pour toi ?
Effectivement, on commence par compter les électrons impliqués :
Cl : Z = 17 -> 1s2 2s2 2p6 3s2 3s5 la couche de valence comprend 7 électrons
O : Z =8 -> 1s2 2s2 2p4 donc la couche de valence comprend 6 électrons
Si on fait le total, on a 1 Cl + 4 O + une charge négative = 1 × 7 + 4 × 6 + 1 = 32 électrons
On commence par placer le chlore au centre, entouré de ses 7 électrons.
Autour de lui, on place les 4 oxygènes, auxquels on attribue leurs 6 électrons respectifs.
Il nous manque donc l'électron supplémentaire de la charge négative, mais on le placera ultérieurement.
Avec cette configuration, tu remarques que tu peux effectuer 3 doubles liaisons Cl=O + 1 liaison simple Cl-O.
De cette façon, tous les électrons du chlore sont mobilisés !
Ensuite, avec les électrons restant sur les oxygènes, tu formes des doublets non-liant : sur les 3 oxygènes directement liés au chlore, on forme deux doublets non-liants.
Reste l'oxygène à simple liaison, pour lequel on a 2 doublets + 1 électron célibataire : c'est donc ici qu'on ajoutera notre électron supplémentaire ! Étant donné qu'il sera entouré de 7 électrons (1 simple liaison + 3 doublets non-liants), il portera donc la charge négative de la molécule.
Est-ce que c'est plus clair pour toi ?

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Lewis ClO4-
Lewis ClO4-
Salut 
Il y a quant même un point que je ne comprend pas trop. Normalement, dans la représentation de Lewis, il me semble que l'on doit faire en sorte que la règle du duet et de l'octet soit respectée. Or, ici, le chlore, vu qu'il forme trois doubles liaisons Cl=O et une double liaison Cl-O, ne la respecte pas dans cette molécule. Cela veut-il dire que, dans une molécule, un atome ne respecte pas forcément l'octet? Et dans ce cas, comment savoir quels atomes doivent respecter l'octet ou non?
Un grand merci d'avance
Il y a quant même un point que je ne comprend pas trop. Normalement, dans la représentation de Lewis, il me semble que l'on doit faire en sorte que la règle du duet et de l'octet soit respectée. Or, ici, le chlore, vu qu'il forme trois doubles liaisons Cl=O et une double liaison Cl-O, ne la respecte pas dans cette molécule. Cela veut-il dire que, dans une molécule, un atome ne respecte pas forcément l'octet? Et dans ce cas, comment savoir quels atomes doivent respecter l'octet ou non?
Un grand merci d'avance
Albatar- Messages : 151
Date d'inscription : 03/10/2019
 Re: Lewis ClO-4
Re: Lewis ClO-4
heyy ,
selon moi pour vérifier la règle de l'octet : 1 liaison sigma compte pour 2 électrons!
donc dans notre cas le Cl fait un liaison simple avec un O: 2 électrons et 3 doubles liaisons donc 3 x 2 = 6 électrons, (on ne compte pas les électrons de la liaison pi) donc le Cl respecte bien la règle de l'octet!
En plus pour moi une molécule si elle ne respecte pas la loi de duet ou de l'octet , on le marque soit par un doublet non liant soit par une case vacante selon le cas !
j'espère qu'un tuteur peut vérifier si je ne dis pas n'importe pas
et merci beaucoup à l'asticoo pour ta réponse sur claire !!
selon moi pour vérifier la règle de l'octet : 1 liaison sigma compte pour 2 électrons!
donc dans notre cas le Cl fait un liaison simple avec un O: 2 électrons et 3 doubles liaisons donc 3 x 2 = 6 électrons, (on ne compte pas les électrons de la liaison pi) donc le Cl respecte bien la règle de l'octet!
En plus pour moi une molécule si elle ne respecte pas la loi de duet ou de l'octet , on le marque soit par un doublet non liant soit par une case vacante selon le cas !
j'espère qu'un tuteur peut vérifier si je ne dis pas n'importe pas
et merci beaucoup à l'asticoo pour ta réponse sur claire !!
budapest- Messages : 52
Date d'inscription : 15/10/2018
 Re: Lewis ClO-4
Re: Lewis ClO-4
Salut !
Merci pour ta réponse amsterdam alors en réalité il y a des exceptions à la règle de l'octet :
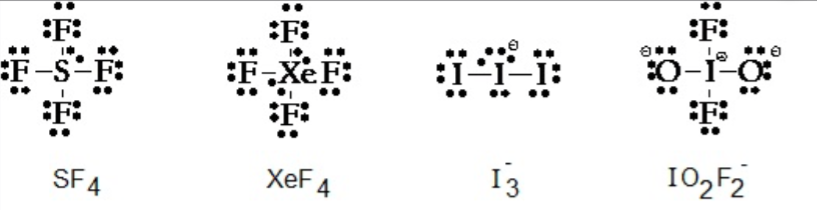
On avait mis les exceptions de type S ou P dans le diapo du tutorat je crois bien, gardez le à l'esprit si jamais vous voyez que vous avez placé tous vos électrons mais que cette règle n'est pas respectée : elle n'est pas systématique
Sinon on compte les électrons des liaisons pi et sigma par exemple dans CO2 on voit que le C atteint l'octet grâce à ses deux liaisons doubles
Bon courage !!
Merci pour ta réponse amsterdam alors en réalité il y a des exceptions à la règle de l'octet :

On avait mis les exceptions de type S ou P dans le diapo du tutorat je crois bien, gardez le à l'esprit si jamais vous voyez que vous avez placé tous vos électrons mais que cette règle n'est pas respectée : elle n'est pas systématique
Sinon on compte les électrons des liaisons pi et sigma par exemple dans CO2 on voit que le C atteint l'octet grâce à ses deux liaisons doubles
Bon courage !!
Gabrielle.G- Messages : 179
Date d'inscription : 15/10/2017
 Re: Lewis ClO-4
Re: Lewis ClO-4
salut
quelqu'un peut m'expliquer comment calculer les electrons de valence pour une molecule ? es ce que on doit prendre en compte le - si jamais la molecule est CLO4- par ex?
merciii
quelqu'un peut m'expliquer comment calculer les electrons de valence pour une molecule ? es ce que on doit prendre en compte le - si jamais la molecule est CLO4- par ex?
merciii
b2019- Messages : 73
Date d'inscription : 31/10/2019
 Re: Lewis ClO-4
Re: Lewis ClO-4
Salut,
alors pour trouver le nombre d'électrons de valence soit tu les connais par le tableau périodique (comme halogène = 7) ou alors on te donne le Z et quand tu fais la règle de Klechkowski tu vas pouvoir voir le nombre d'électrons de valence.
Quand ta molécule est chargée il faut prendre en compte cette charge pck ca veut dire que t'as molécule a volé ou s'est fait racketté d'un électron
Bon courage.
alors pour trouver le nombre d'électrons de valence soit tu les connais par le tableau périodique (comme halogène = 7) ou alors on te donne le Z et quand tu fais la règle de Klechkowski tu vas pouvoir voir le nombre d'électrons de valence.
Quand ta molécule est chargée il faut prendre en compte cette charge pck ca veut dire que t'as molécule a volé ou s'est fait racketté d'un électron
Bon courage.
Grincheux- Messages : 29
Date d'inscription : 24/09/2019
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum