Etats de la matière et leurs caractéristiques
2 participants
Page 1 sur 1
 Etats de la matière et leurs caractéristiques
Etats de la matière et leurs caractéristiques
Bonjour
J'ai quelques questions cours par rapport au premier chapitre sur les états de la matiere
1. Un solide est il vraiment incompressible ?
2. " Un liquide est un fluide peur prendre forme quelconque si soumis système de forces convenables, aussi faibles qu’elles soient ", est ce aussi le cas du gaz ?
3. Entre molécules de fluide , y a t il des forces adhésion ou cohésion ?
4. Pour la molalité, La masse du solvant peut on l’approximer à la masse de la soltion ( comme pour la molarité ) ?
5. En cas ou en atteint limite de solubilité , on néglige toujours le volume de soluté ?
6. Comment savoir si on a une dissociation totale ou partielle avec le coefficient alpha d'un soluté dans une solution ?
7. Dans la formule de la Concentration osmolaire, Pourquoi le principe de la conservation de la matière n'est pas respecté ?
8. Comment passer de osmol en mol ? logiquement c’est la meme chose non ?
9. Dans la formule pour calculer la pression partielle d'un composant, peut on remplacer le fraction molaire par la fraction massique ou volumique du composant en question ?
10. En statique, c’est les molécules ou les particules qui ne bougent pas ?
11. La difference entre vaporisation, évaporation et ébullition ?
12. Je ne comprends pas la formule dudegré hygrométrique ? à quoi corresponds le pression partielle et totale ? Je vois pas comment on pourra l'appliquer ?
13. L'état supercritique est ce que c'est un quatrième état de la matière ?
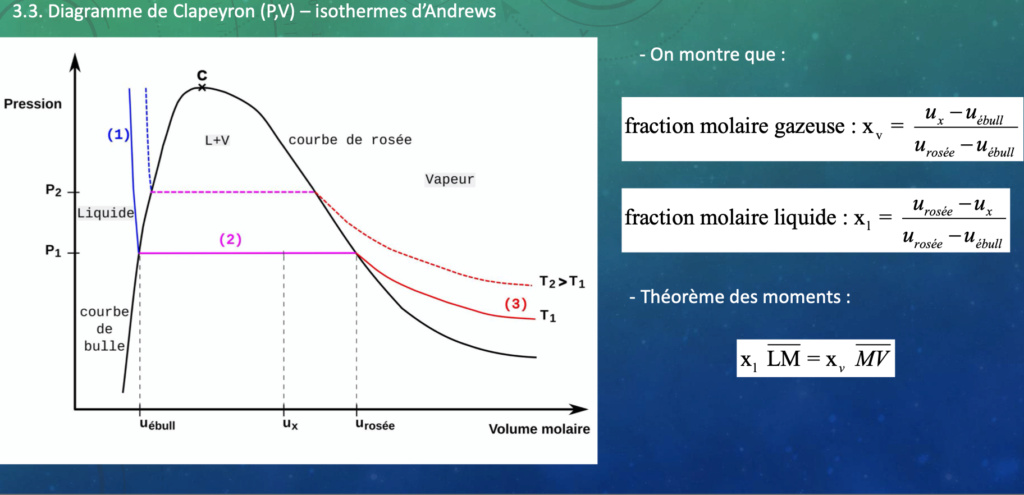
14. Théorème des moments il n a pas été vraiment détaillé par le prof, je ne comprends pas à quoi correspondent les lettre M,N....etc ? ( je comprends que Xl et Xv )
J'ai quelques questions cours par rapport au premier chapitre sur les états de la matiere
1. Un solide est il vraiment incompressible ?
2. " Un liquide est un fluide peur prendre forme quelconque si soumis système de forces convenables, aussi faibles qu’elles soient ", est ce aussi le cas du gaz ?
3. Entre molécules de fluide , y a t il des forces adhésion ou cohésion ?
4. Pour la molalité, La masse du solvant peut on l’approximer à la masse de la soltion ( comme pour la molarité ) ?
5. En cas ou en atteint limite de solubilité , on néglige toujours le volume de soluté ?
6. Comment savoir si on a une dissociation totale ou partielle avec le coefficient alpha d'un soluté dans une solution ?
7. Dans la formule de la Concentration osmolaire, Pourquoi le principe de la conservation de la matière n'est pas respecté ?
8. Comment passer de osmol en mol ? logiquement c’est la meme chose non ?
9. Dans la formule pour calculer la pression partielle d'un composant, peut on remplacer le fraction molaire par la fraction massique ou volumique du composant en question ?
10. En statique, c’est les molécules ou les particules qui ne bougent pas ?
11. La difference entre vaporisation, évaporation et ébullition ?
12. Je ne comprends pas la formule dudegré hygrométrique ? à quoi corresponds le pression partielle et totale ? Je vois pas comment on pourra l'appliquer ?
13. L'état supercritique est ce que c'est un quatrième état de la matière ?
14. Théorème des moments il n a pas été vraiment détaillé par le prof, je ne comprends pas à quoi correspondent les lettre M,N....etc ? ( je comprends que Xl et Xv )


asmathique- Messages : 58
Date d'inscription : 04/09/2020
Age : 21
 Re: Etats de la matière et leurs caractéristiques
Re: Etats de la matière et leurs caractéristiques
Salut !
ça fait beaucoup de questions tout ça !
on est parti !!
1) Les solides sont incompressibles (en pratique, il y a un léger degré de compressibilité mais totalement négligeable. Retiens incompressible pour bien faire la différence avec les autres états de la matière)
2) Pour qu'un gaz prenne une forme quelconque, il faut l'enfermer dans un espace clos qui a la forme désirée. Donc il n'est pas vraiment soumis à des forces, c'est plus une exploitation de ses caractéristiques physiques
3) La cohésion permet de caractériser l'ensemble des forces qui permettent de réunir les molécules d'un même élément physique (donc possiblement un fluide). L'adhésion physique s'exerce entre des particules de différents éléments physiques.
4) Cela dépendra de ton soluté : s'il a une masse molaire élevée et que tu en as introduit une grande quantité de matière en solution, ce n'est pas forcément possible. Ca sera indiqué.
5) Tout dépend de la précision que tu veux également. Si tu l'as dépassé de beaucoup, est-ce que ça vaut le coup de calculer une concentration molale sachant que la solution est saturée ?
6) La dissociation sera totale avec un alpha = 1
Dans tous les autres cas elle est partielle
(sauf dans le cas d'une concentration très faible. Cf loi d'Ostwald si ça t'intéresse de faire plus de physique)
7) LA conservation de matière est respectée. Ce qui n'est pas respectée est le nombre de molécules qui change entre état initial et état final (principe d'une réaction :p)
 Les osmoles prennent en compte le nombre de molécules actives. Elles différents d'une simple mole par le fait que une mole de substrat peut donner deux produits (ex : NaOH --> Na+ + OH-). En ce cas, si tu avais une mole de NaOH, tu obtiendrais après dissociation totale une mole de Na+ et une mole de OH-, soit 2 moles d'espèces actives en solution à l'état final.
Les osmoles prennent en compte le nombre de molécules actives. Elles différents d'une simple mole par le fait que une mole de substrat peut donner deux produits (ex : NaOH --> Na+ + OH-). En ce cas, si tu avais une mole de NaOH, tu obtiendrais après dissociation totale une mole de Na+ et une mole de OH-, soit 2 moles d'espèces actives en solution à l'état final.
9) Non, il me semble que tu dois bien garder la fraction molaire.
10) Une particule est une simple réunion d'une quantité infinitésimale de molécules. Donc particule = plein de molécules.
La statique des fluides ne veut pas dire que les molécules ne bougent pas (tjrs du mouvement), ça signifie que macroscopiquement il n'y a pas de mouvement.
11) Il existe 2 types de vaporisation :
- l'ébullition, qui se produit lorsque la température de l'eau atteint 100°C.
- l'évaporation, qui se produit à la surface du liquide, à l'aide de la chaleur et du vent.
12) Le degré hygrométrique est le rapport entre la pression partielle de l'eau sous forme vapeur et la pression de vapeur saturante de l'eau.
cela te permet de savoir l'humidité relative (pourcentage d'eau sous forme vapeur dans une atmosphère par exemple).
13) C'est plus un cas particulier qu'un véritable 4e état. Le fluide en état supercritique se comporte comme un gaz mais a la densité d'un liquide.
14) Ton L est à l'interface entre courbe rose / bleue / noir
Ton M se trouve sur la courbe rose (partie (2) )
Ton V se trouve au point réunissant rose / rouge / noir
=> ce sotn des valeurs algébriques qui qualifie une distance
LM = distance de u(ébullition) à u(x)
Voilà voilà
Hésite pas à venir en perm également, c'est plus simple pour répondre à une rafale de questions
Bon courage !
ça fait beaucoup de questions tout ça !

on est parti !!
1) Les solides sont incompressibles (en pratique, il y a un léger degré de compressibilité mais totalement négligeable. Retiens incompressible pour bien faire la différence avec les autres états de la matière)
2) Pour qu'un gaz prenne une forme quelconque, il faut l'enfermer dans un espace clos qui a la forme désirée. Donc il n'est pas vraiment soumis à des forces, c'est plus une exploitation de ses caractéristiques physiques
3) La cohésion permet de caractériser l'ensemble des forces qui permettent de réunir les molécules d'un même élément physique (donc possiblement un fluide). L'adhésion physique s'exerce entre des particules de différents éléments physiques.
4) Cela dépendra de ton soluté : s'il a une masse molaire élevée et que tu en as introduit une grande quantité de matière en solution, ce n'est pas forcément possible. Ca sera indiqué.
5) Tout dépend de la précision que tu veux également. Si tu l'as dépassé de beaucoup, est-ce que ça vaut le coup de calculer une concentration molale sachant que la solution est saturée ?
6) La dissociation sera totale avec un alpha = 1
Dans tous les autres cas elle est partielle
(sauf dans le cas d'une concentration très faible. Cf loi d'Ostwald si ça t'intéresse de faire plus de physique)
7) LA conservation de matière est respectée. Ce qui n'est pas respectée est le nombre de molécules qui change entre état initial et état final (principe d'une réaction :p)
9) Non, il me semble que tu dois bien garder la fraction molaire.
10) Une particule est une simple réunion d'une quantité infinitésimale de molécules. Donc particule = plein de molécules.
La statique des fluides ne veut pas dire que les molécules ne bougent pas (tjrs du mouvement), ça signifie que macroscopiquement il n'y a pas de mouvement.
11) Il existe 2 types de vaporisation :
- l'ébullition, qui se produit lorsque la température de l'eau atteint 100°C.
- l'évaporation, qui se produit à la surface du liquide, à l'aide de la chaleur et du vent.
12) Le degré hygrométrique est le rapport entre la pression partielle de l'eau sous forme vapeur et la pression de vapeur saturante de l'eau.
cela te permet de savoir l'humidité relative (pourcentage d'eau sous forme vapeur dans une atmosphère par exemple).
13) C'est plus un cas particulier qu'un véritable 4e état. Le fluide en état supercritique se comporte comme un gaz mais a la densité d'un liquide.
14) Ton L est à l'interface entre courbe rose / bleue / noir
Ton M se trouve sur la courbe rose (partie (2) )
Ton V se trouve au point réunissant rose / rouge / noir
=> ce sotn des valeurs algébriques qui qualifie une distance
LM = distance de u(ébullition) à u(x)
Voilà voilà
Hésite pas à venir en perm également, c'est plus simple pour répondre à une rafale de questions
Bon courage !

Brutus- Admin
- Messages : 318
Date d'inscription : 29/11/2017
Age : 23
Localisation : Déni
Emploi/loisirs : Rouler sur les gens
 Sujets similaires
Sujets similaires» TD n.1 Outils mathématiques, Métrologie, Etats de la matière et leurs caractérisations
» exo tuto états de la matière
» Densité moléculaire de l'eau liquide Nv: ED1 exo 1 (états de la matière)
» Conservation de la matière
» Matière et antimatière
» exo tuto états de la matière
» Densité moléculaire de l'eau liquide Nv: ED1 exo 1 (états de la matière)
» Conservation de la matière
» Matière et antimatière
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|
