orbitale moleculaire
+11
moqi
Falbala
Lumberjack
Florent
Mole
Moustik
Loïc Apolda
Taurine
Aviator
Dudu
sparkchelsea
15 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 2
Page 1 sur 2 • 1, 2 
 orbitale moleculaire
orbitale moleculaire
Bonjour pourriez vous m aider svp:
soit une molécule de dioxygene . on construit le diagramme d énergie moléculaire correspondant dans lequel on néglige le niveau 2s^2
A) on obtient 2 Orbitales moléculaire anti-liantes
B) on obtient 3 OM anti-liantes
C) on obtient 2 OM sigma-pz et sigma-pz*
Toutes ses réponses sont elles fausses ou dit t on quand même que l on obtient une OM même si elle n est "composée" que d un (ou meme de zero) electron?
moi j aurais tendance a dire que toutes ces reponses sont fausses et que l on obtient une OM que si elle est composee de 2 electrons mais apres on a vu aussi dans le cours que n OA= n OM alors je suis un peu perdue pour repondre a cette question
Merci d avance
soit une molécule de dioxygene . on construit le diagramme d énergie moléculaire correspondant dans lequel on néglige le niveau 2s^2
A) on obtient 2 Orbitales moléculaire anti-liantes
B) on obtient 3 OM anti-liantes
C) on obtient 2 OM sigma-pz et sigma-pz*
Toutes ses réponses sont elles fausses ou dit t on quand même que l on obtient une OM même si elle n est "composée" que d un (ou meme de zero) electron?
moi j aurais tendance a dire que toutes ces reponses sont fausses et que l on obtient une OM que si elle est composee de 2 electrons mais apres on a vu aussi dans le cours que n OA= n OM alors je suis un peu perdue pour repondre a cette question
Merci d avance
sparkchelsea- Messages : 3
Date d'inscription : 08/11/2012
 Re: orbitale moleculaire
Re: orbitale moleculaire
bonjour sparkchelsea,
Si tu fais un diagramme de liaison pour le dioxygène tu obtiens :

soit 3 OM liantes et 2 anti-liantes,
une orbitale correspond en gros au déplacement de tes/ton électrons autour de l'atome, si tu as un électrons dans une orbitale il ne va pas rester immobile, il va bouger! Donc ton orbitale existe belle et bien!
(par contre si tu n'as pas d'électrons dedans, elle n’existe pas. Une orbitale est une vue de l'esprit pour pouvoir se représenter les choses, concrètement elle ne se voit pas! on ne peut voir que les électrons (et encore... ^^)
Si tu fais un diagramme de liaison pour le dioxygène tu obtiens :

soit 3 OM liantes et 2 anti-liantes,
une orbitale correspond en gros au déplacement de tes/ton électrons autour de l'atome, si tu as un électrons dans une orbitale il ne va pas rester immobile, il va bouger! Donc ton orbitale existe belle et bien!
(par contre si tu n'as pas d'électrons dedans, elle n’existe pas. Une orbitale est une vue de l'esprit pour pouvoir se représenter les choses, concrètement elle ne se voit pas! on ne peut voir que les électrons (et encore... ^^)

Dudu- Messages : 145
Date d'inscription : 10/09/2011
Age : 31
 Re: orbitale moleculaire
Re: orbitale moleculaire
Salut !
Je suis pas tout a fait d'accord sur le fait qu'il existerait uniquement 2 OM anti-liantes. Personnellement à cette question j'aurais répondu B. Car, et dites les moi si je me trompes, même si c'est juste un modele et que ca n'existe pas réellement, Boury a bien dit : nOA donne nOM, donc ici comme les atomes apportent chacun 3 OA, la molécule comprendra bien 6 OM soit 3 liantes et 3 anti-liantes. Et cela meme si la sigma* n'est pas pleine.
L'exemple du cours était la molécule de dihydrogène, sur celle ci, chaque atome d'H apportait 1 électron par OA, et sur le diagramme de liaison, meme si l'orbitale sigma* n'était pas remplie, Boury a dit qu'on avait 2 OM.
Dites moi vraiment si je me trompe.
Je suis pas tout a fait d'accord sur le fait qu'il existerait uniquement 2 OM anti-liantes. Personnellement à cette question j'aurais répondu B. Car, et dites les moi si je me trompes, même si c'est juste un modele et que ca n'existe pas réellement, Boury a bien dit : nOA donne nOM, donc ici comme les atomes apportent chacun 3 OA, la molécule comprendra bien 6 OM soit 3 liantes et 3 anti-liantes. Et cela meme si la sigma* n'est pas pleine.
L'exemple du cours était la molécule de dihydrogène, sur celle ci, chaque atome d'H apportait 1 électron par OA, et sur le diagramme de liaison, meme si l'orbitale sigma* n'était pas remplie, Boury a dit qu'on avait 2 OM.
Dites moi vraiment si je me trompe.
Aviator- Messages : 69
Date d'inscription : 17/10/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
Hum.... ceci est litigieux! je suis entièrement d'accord sur le fait que nOA=nOM donc de ce fait là on aura tout le temps les 2/6/8 OM... mais est ce que boubou pense à ça quand il fait ses questions ou il pense aux orbitales remplies? (qui sont importantes du fait des électrons pour les OL...) Là je ne peux pas te répondre désolé :/ peut être un autre tuteur sera t'éclairer?

Dudu- Messages : 145
Date d'inscription : 10/09/2011
Age : 31
 Re: orbitale moleculaire
Re: orbitale moleculaire
Oui très litigieux surtout qu'il aime bien ce genre de questions, et qu'on est a une semaine de sssssssss.
Je pense qu'il fait ça pour bien voir ceux qui ont compris la règle et ceux qui ne l'on pas prise en compte. Apres je me trompe peut etre. j'en sais rien.
De l'aide de l'aide vite ....
Je pense qu'il fait ça pour bien voir ceux qui ont compris la règle et ceux qui ne l'on pas prise en compte. Apres je me trompe peut etre. j'en sais rien.
De l'aide de l'aide vite ....
Aviator- Messages : 69
Date d'inscription : 17/10/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
Pour cette question perso j'ai répondu :
6 o M dont 3 liantes
ordre de liaison pour sigma = 1
pour pi idem
ordre global = 2
et la molécule présente 2 e- célib
Par contre, sur le même thème on utilise quelle technique pour représenter le diagramme mol d'une seule liaison ?
6 o M dont 3 liantes
ordre de liaison pour sigma = 1
pour pi idem
ordre global = 2
et la molécule présente 2 e- célib
Par contre, sur le même thème on utilise quelle technique pour représenter le diagramme mol d'une seule liaison ?

Taurine- Messages : 90
Date d'inscription : 27/10/2012
Age : 30
Localisation : Lille
 Re: orbitale moleculaire
Re: orbitale moleculaire
Alors oui effectivement c'est un peu subjectif. Car dans le modèle théorique aviator a complètement raison. Ce n'est pas parce qu'elle est vide qu'elle n'est pas subjectivement présente. Surtout que les électrons sont en permanence en mouvement entre les orbitales liantes et non liantes.
Cependant je pense que le sens de sa question est rapporté concrètement à l'exemple de la molécule d'O2 et à la représentation que l'on obtient en remplissant correctement le diagramme.
Donc personnellement j'aurais répondu la même chose que dudu à ce qcm.
Soit:
3 OM liantes et 2 anti-liantes en négligeant le niveau 2s2
avec:
ordre de liaison pour sigma et pi = 1
ordre global = 2
Et taurine, qu'entends tu par représenter le diagramme moléculaire d'une seule liaison? Car un diagramme te permet de visualiser l’interaction des électrons entre 2 éléments liés. Et ceci, même si après tu peux le déduire, indépendamment du fait que tu es une simple ou double liaison entre ces 2 molécules.
Cependant je pense que le sens de sa question est rapporté concrètement à l'exemple de la molécule d'O2 et à la représentation que l'on obtient en remplissant correctement le diagramme.
Donc personnellement j'aurais répondu la même chose que dudu à ce qcm.
Soit:
3 OM liantes et 2 anti-liantes en négligeant le niveau 2s2
avec:
ordre de liaison pour sigma et pi = 1
ordre global = 2
Et taurine, qu'entends tu par représenter le diagramme moléculaire d'une seule liaison? Car un diagramme te permet de visualiser l’interaction des électrons entre 2 éléments liés. Et ceci, même si après tu peux le déduire, indépendamment du fait que tu es une simple ou double liaison entre ces 2 molécules.
Loïc Apolda- Messages : 17
Date d'inscription : 14/02/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
Okay compris ! Merci Loïc.
Aviator- Messages : 69
Date d'inscription : 17/10/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
Bonjour,
Pour trouver l'ordre de liaison de sigma et pi, il suffit juste de la représenter dans le modèle de Lewis et de le déduire ou il y a une autre facon de faire ?
Merci d'avance
Pour trouver l'ordre de liaison de sigma et pi, il suffit juste de la représenter dans le modèle de Lewis et de le déduire ou il y a une autre facon de faire ?
Merci d'avance
Moustik- Messages : 27
Date d'inscription : 17/10/2012
 Re: orbitale moleculaire
Re: orbitale moleculaire
En 2009 on demandait pr la molecule de SCl 2 d'établir le diagramme d'energie moleculaire pour une seule liaison S- Cl

Taurine- Messages : 90
Date d'inscription : 27/10/2012
Age : 30
Localisation : Lille
 Re: orbitale moleculaire
Re: orbitale moleculaire
Tu vas faire exactement de la même manière que pour calculer l 'OL global (liant - antiliant)/2 sauf que tu ne vas considérer que les e- sur les orbitales sigma(pour l'OL sigma), soit la 1ere et 4ième ligne de ton diagramme, ou sur les orbitales pi (pour l'OL pi), soit la 2ième et 3ième ligne de ton diagramme.
Donc ici pour l'OL sigma = (2-0)/2 = 1
et pour l'OL pi = (4-2)/2 = 1
Et enfin pour l'OL global = (6-2)/2 = 2
Voili Voilou,
Bon courage!
Donc ici pour l'OL sigma = (2-0)/2 = 1
et pour l'OL pi = (4-2)/2 = 1
Et enfin pour l'OL global = (6-2)/2 = 2
Voili Voilou,
Bon courage!
Loïc Apolda- Messages : 17
Date d'inscription : 14/02/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
Daco merchiii 

Taurine- Messages : 90
Date d'inscription : 27/10/2012
Age : 30
Localisation : Lille
 Re: orbitale moleculaire
Re: orbitale moleculaire
Et si par exemple, on avait pas une molécule à 2 atomes mais plutot 3: exemple du CO2
On nous demande par exemple le diagramme pour une seule liaison C-O. On trouvera un OL sigma de 1 pour le carbonne, or dans la molécule son ordre de liaison sigma est de 2 vu qu'il fait aussi une liaison avec l'autre O. Comment fait-on dans ce cas là. Boury considère une seule liaisons ou la molécule entière ?
Un peu tiré par les cheveux mais bon.
On nous demande par exemple le diagramme pour une seule liaison C-O. On trouvera un OL sigma de 1 pour le carbonne, or dans la molécule son ordre de liaison sigma est de 2 vu qu'il fait aussi une liaison avec l'autre O. Comment fait-on dans ce cas là. Boury considère une seule liaisons ou la molécule entière ?
Un peu tiré par les cheveux mais bon.
Aviator- Messages : 69
Date d'inscription : 17/10/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
alors en fait quand tu veux faire des diagrammes pour 3 molécules c'est hyper complexe.
J'avais été poser la question à bourry quand j'étais en P1 et je me rappelle qu'il m'avait dit que pour simplifier il ne fallait faire le diagramme qu'avec les électrons qui rentraient en jeux dans la construction.
Par exemple pour le CO2:
On va prendre l'état hybridé du carbone et ne le lier qu'avec un seul 0 en sautant une fois sur 2 un e- qui normalement part avec l'autre 0. (Comme si on coupait en 2 la molécule de carbone). Et en mettant en non liant les e- de la couche s de O.
Mais j'en avais aussi parlé avec le prof d'ed monprofdechimie@free.fr (dont je ne me rappelle plus le prénom), qui est aussi prof de chimie à HEI. Il m'avait répondu de faire comme ça, vu qu'on avait pas le niveau pour les faire complètement, mais que c'était une très grosse approximation à la bourry.
Je suppose donc que pour la molécule de SCL2 il faut faire pareil. Monter ton diagramme sans te préoccuper de la couche s et répartir les e- du souffre entre les 2 chlore pour la couche p. Ainsi s'il te demande une seule liaison tu ne mets qu'un seul côté de ton diagramme...
J'avais été poser la question à bourry quand j'étais en P1 et je me rappelle qu'il m'avait dit que pour simplifier il ne fallait faire le diagramme qu'avec les électrons qui rentraient en jeux dans la construction.
Par exemple pour le CO2:
On va prendre l'état hybridé du carbone et ne le lier qu'avec un seul 0 en sautant une fois sur 2 un e- qui normalement part avec l'autre 0. (Comme si on coupait en 2 la molécule de carbone). Et en mettant en non liant les e- de la couche s de O.
Mais j'en avais aussi parlé avec le prof d'ed monprofdechimie@free.fr (dont je ne me rappelle plus le prénom), qui est aussi prof de chimie à HEI. Il m'avait répondu de faire comme ça, vu qu'on avait pas le niveau pour les faire complètement, mais que c'était une très grosse approximation à la bourry.
Je suppose donc que pour la molécule de SCL2 il faut faire pareil. Monter ton diagramme sans te préoccuper de la couche s et répartir les e- du souffre entre les 2 chlore pour la couche p. Ainsi s'il te demande une seule liaison tu ne mets qu'un seul côté de ton diagramme...
Loïc Apolda- Messages : 17
Date d'inscription : 14/02/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
Si j'ai bien compris dans notre diagramme CO on met les orbitales hybridées du C et non pas les orbitales à l'état fondamental, n'est ce pas ?
Je te remercie beaucoup. Ca faisait longtemps que je me posais la question mais vu que Bouurry est parti sans laisser d'adresse bah, ma question est restée sans réponse.
Alors merci. Au final je pense pas qu'il va nous compliquer la tache autant que ça mais c'est toujours bon a savoir !
Je te remercie beaucoup. Ca faisait longtemps que je me posais la question mais vu que Bouurry est parti sans laisser d'adresse bah, ma question est restée sans réponse.
Alors merci. Au final je pense pas qu'il va nous compliquer la tache autant que ça mais c'est toujours bon a savoir !
Aviator- Messages : 69
Date d'inscription : 17/10/2011
 Re: orbitale moleculaire
Re: orbitale moleculaire
coucou, quand est ce qu'on peut vraiment dire qu'une orbitale est non liante ?
si elle possède un electron non apparié c'est suffisant pour le dire ?
si elle possède un electron non apparié c'est suffisant pour le dire ?
Falbala- Messages : 123
Date d'inscription : 04/10/2012
Age : 29
 Re: orbitale moleculaire
Re: orbitale moleculaire
La proposition "la molécule a deux électrons célibataires" est exacte ?
Mole- Messages : 6
Date d'inscription : 05/12/2012
 Re: orbitale moleculaire
Re: orbitale moleculaire
Le dioxygéne ? Oui il en a deux, on les voit sur le diagramme 
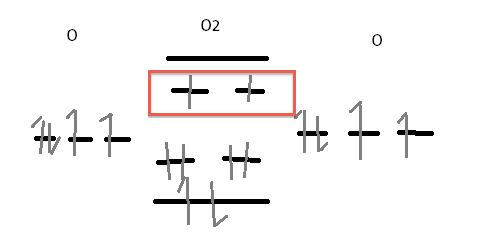


Florent- Messages : 43
Date d'inscription : 23/11/2012
Age : 29
Localisation : Lille
Emploi/loisirs : Travailler
 Re: orbitale moleculaire
Re: orbitale moleculaire
Pour compléter, cela donne à l'oxygène des propriétés paramagnétiques. 
Lumberjack- Messages : 32
Date d'inscription : 27/09/2012
 Re: orbitale moleculaire
Re: orbitale moleculaire
donc il a deux orbitales anti liantes et non liantes c'est bien ca ? des qu'un electron est seul dans une orbitale il est donc considérer comme non liants mais dans ce cas pourquoi dans le diagramme de HCl on dit qu'il y a deux orbitales non liantes également ?
Falbala- Messages : 123
Date d'inscription : 04/10/2012
Age : 29
 Re: orbitale moleculaire
Re: orbitale moleculaire
pour le dioxygène il y a 3 orbitales liantes et 2 antiliante, il n'y a pas de nonliante!!
les orbitales nonliantes existe s'il n'y a pas de correspondance entre les OA. par exemple pour HCL H partage un électron de sa couche s et Cl de sa couche p. si tu comptes tes orbitales: 1+3=4OA donc 4 OM hors tu n'as pas de correspondance pour toutes les orbitales! pour imager, H donne son orbitale, Cl en donne 1 (soit les sigma et sigma*) et la tu n'a plus les fameuse correspondances, donc les 2 OA restantes du Cl donne les OM nonliante
donc au final tu auras une OM liante, 2 OM non liante et 1 OM anti liante
les orbitales nonliantes existe s'il n'y a pas de correspondance entre les OA. par exemple pour HCL H partage un électron de sa couche s et Cl de sa couche p. si tu comptes tes orbitales: 1+3=4OA donc 4 OM hors tu n'as pas de correspondance pour toutes les orbitales! pour imager, H donne son orbitale, Cl en donne 1 (soit les sigma et sigma*) et la tu n'a plus les fameuse correspondances, donc les 2 OA restantes du Cl donne les OM nonliante
donc au final tu auras une OM liante, 2 OM non liante et 1 OM anti liante

Dudu- Messages : 145
Date d'inscription : 10/09/2011
Age : 31
 Re: orbitale moleculaire
Re: orbitale moleculaire
Pourquoi et une anti liante?? s'il n'y a pas d électrons dessus?
moqi- Messages : 22
Date d'inscription : 22/03/2012
 Re: orbitale moleculaire
Re: orbitale moleculaire
l'anti-liante, c'est à cause/pour le "débat" quelque message plus bas...
et dans mon explication je ne parle pas d'orbitale remplis ou non je parlais d'orbitales "à placer" pour faire un diagramme
et dans mon explication je ne parle pas d'orbitale remplis ou non je parlais d'orbitales "à placer" pour faire un diagramme

Dudu- Messages : 145
Date d'inscription : 10/09/2011
Age : 31
 Re: orbitale moleculaire
Re: orbitale moleculaire
ok ok merci,donc pour le HCl il n y a pas d anti liante..
moqi- Messages : 22
Date d'inscription : 22/03/2012
Page 1 sur 2 • 1, 2 
 Sujets similaires
Sujets similaires» Orbitale Moléculaire liante et non liante
» Diagramme orbitale
» Nombre d'électrons par orbitale
» Diagramme moléculaire
» Diagramme moléculaire
» Diagramme orbitale
» Nombre d'électrons par orbitale
» Diagramme moléculaire
» Diagramme moléculaire
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 2
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|


