TK2 2018-19
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: CHIMIE GENERALE
Page 1 sur 1
 Re: TK2 2018-19
Re: TK2 2018-19
Salut !
Pour résoudre cet exercice, tu as 2 méthodes : la première, classique, en utilisant le diagramme de Hess, et la deuxième (utilisable ici mais pas tout le temps) en utilisant la formule sur les enthalpies de formation.
Méthode 1
On te demande l'enthalpie de combustion du C3H7OH, donc tu vas partir de ta molécule à laquelle tu ajoutes du dioxygène, pour former du CO2 et de l'H2O.
Tu équilibres ensuite ta réaction, ce qui va donner :
On va appeler cette réaction l'étape 1
Ensuite, tu cherches à déterminer quelles étapes tu peux créer pour pouvoir retomber sur le CO2 et l'H2O.
Sachant que tu as des enthalpies de formation, tu vas commencer par ''détruire'' ton C3H7OH pour obtenir des corps simples, à partir desquels tu pourras recréer ce que tu veux.
Donc tu pars de ta molécule de base et tu appliques l'inverse de ton enthalpie de formation pour obtenir du carbone graphite, du dihydrogène et du dioxygène, ce qui donne :
On va appeler cette réaction l'étape 2
Et enfin, tu vas chercher à rejoindre la première étape en créant du CO2 et de l'H2O à partir de tes corps simples (puisqu'on te donne des enthalpies de formation).
Tu vas donc avoir :
On va appeler cette réaction l'étape 3
À partir de ça, tu obtiens le diagramme suivant :
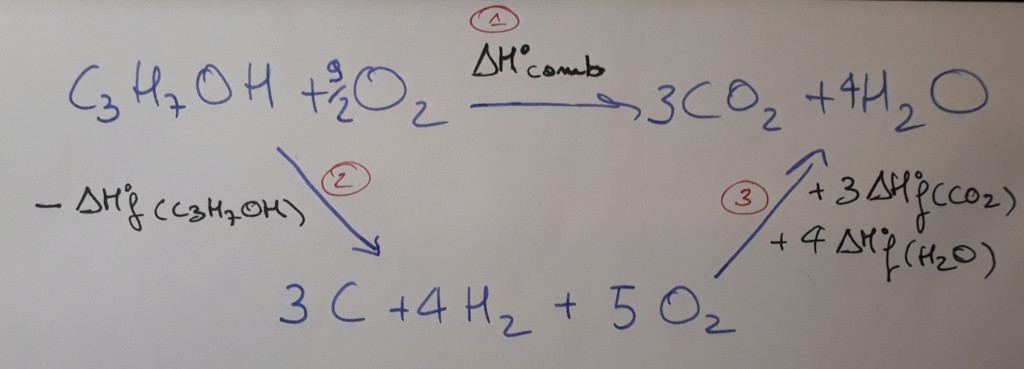
Et donc tu remarques que : ΔH°comb (C3H7OH) = - ΔH°f(C3H7OH) + 3 ΔH°f(CO2) + 4 ΔH°f(H2O)
Tu remplaces par les valeurs numériques et tu obtiens ΔH°comb (C3H7OH) =- 2 021,2 kJ/mol
Méthode 2
Dans ton cours, tu as une formule permettant de déterminer une enthalpie de réaction à partir des enthalpies de formation des produits et des réactifs.
Ici tu as toutes les données nécessaires à l'application de cette formule alors tu peux l'appliquer !
ΔH°comb = 3 ΔH°f(CO2) + 4 ΔH°f(H2O) - ΔH°f(C3H7OH)
(On ne prend pas en compte l'O2 car il s'agit d'un corps simple, donc son enthalpie de formation est nulle).
Tu remplaces par les valeurs numériques et tu retombes sur le même résultat !
Voilà voilà j'espère que ça te semble plus clair désormais
Pour résoudre cet exercice, tu as 2 méthodes : la première, classique, en utilisant le diagramme de Hess, et la deuxième (utilisable ici mais pas tout le temps) en utilisant la formule sur les enthalpies de formation.
Méthode 1
On te demande l'enthalpie de combustion du C3H7OH, donc tu vas partir de ta molécule à laquelle tu ajoutes du dioxygène, pour former du CO2 et de l'H2O.
Tu équilibres ensuite ta réaction, ce qui va donner :
C3H7OH + 9/2 O2 -> 3CO2 + 4 H2O
On va appeler cette réaction l'étape 1
Ensuite, tu cherches à déterminer quelles étapes tu peux créer pour pouvoir retomber sur le CO2 et l'H2O.
Sachant que tu as des enthalpies de formation, tu vas commencer par ''détruire'' ton C3H7OH pour obtenir des corps simples, à partir desquels tu pourras recréer ce que tu veux.
Donc tu pars de ta molécule de base et tu appliques l'inverse de ton enthalpie de formation pour obtenir du carbone graphite, du dihydrogène et du dioxygène, ce qui donne :
C3H7OH + 9/2 O2 -> 3 C + 4H2 + 1/2 O2 + 9/2 O2
On va appeler cette réaction l'étape 2
Et enfin, tu vas chercher à rejoindre la première étape en créant du CO2 et de l'H2O à partir de tes corps simples (puisqu'on te donne des enthalpies de formation).
Tu vas donc avoir :
3 C + 4 H2 + 5 O2 -> 3 CO2 + 4 H2O
On va appeler cette réaction l'étape 3
À partir de ça, tu obtiens le diagramme suivant :

Et donc tu remarques que : ΔH°comb (C3H7OH) = - ΔH°f(C3H7OH) + 3 ΔH°f(CO2) + 4 ΔH°f(H2O)
Tu remplaces par les valeurs numériques et tu obtiens ΔH°comb (C3H7OH) =- 2 021,2 kJ/mol
Méthode 2
Dans ton cours, tu as une formule permettant de déterminer une enthalpie de réaction à partir des enthalpies de formation des produits et des réactifs.
ΔH°R = Σ ΔH°f(produits) - Σ ΔH°f(réactifs)
Ici tu as toutes les données nécessaires à l'application de cette formule alors tu peux l'appliquer !
ΔH°comb = 3 ΔH°f(CO2) + 4 ΔH°f(H2O) - ΔH°f(C3H7OH)
(On ne prend pas en compte l'O2 car il s'agit d'un corps simple, donc son enthalpie de formation est nulle).
Tu remplaces par les valeurs numériques et tu retombes sur le même résultat !
Voilà voilà j'espère que ça te semble plus clair désormais

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: TK2 2018-19
Re: TK2 2018-19
Oui !! parfait merci pour ta réponse détaillée, j'y vois beaucoup plus clair maintenant 

(et je comprends mieux mes erreurs)
Encore un grand merci !!!
Pauline
(et je comprends mieux mes erreurs)
Encore un grand merci !!!
Pauline
Pauline92- Messages : 59
Date d'inscription : 05/10/2018
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|

