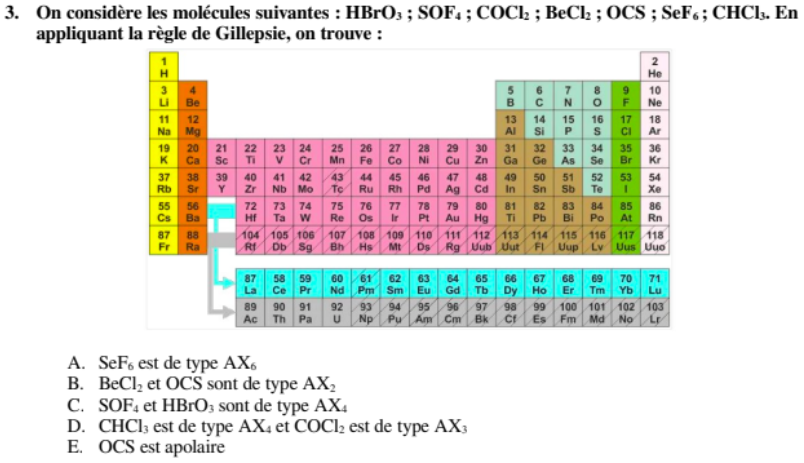
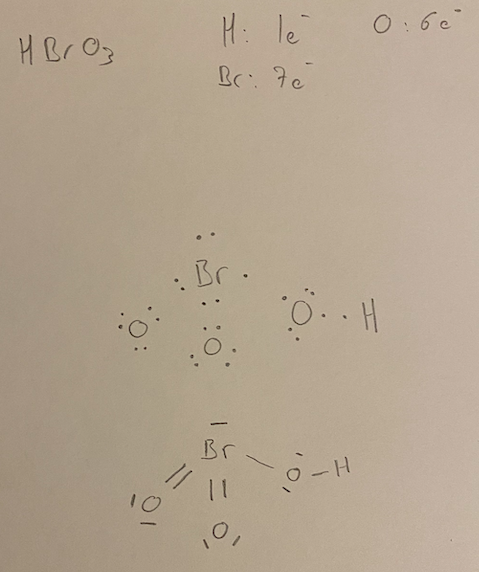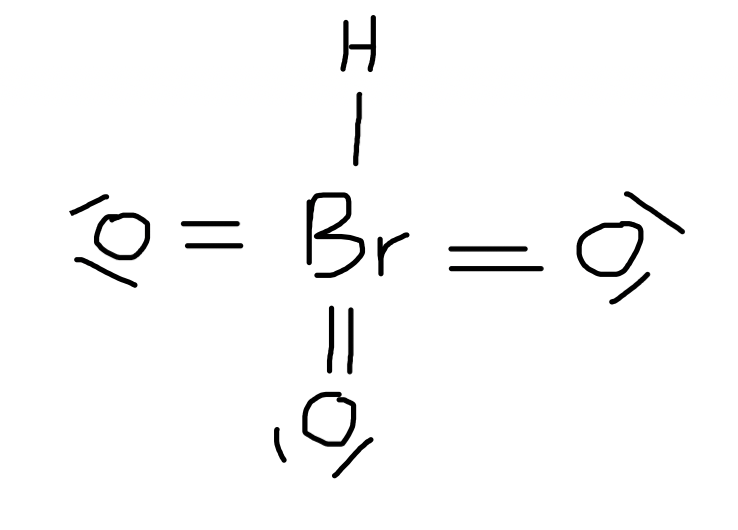Q12 CCB 2020-2021
5 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2020-2021 (Contrôle continu et Concours)
Page 1 sur 1
 Q12 CCB 2020-2021
Q12 CCB 2020-2021
Salut les tuteurs !
Dans cette question la proposition c) "HBrO3 sont de type AX4 et COCl2 est de type AX3" est comptée comme fausse dans la correction de Kaczmarek alors que d'après la correction du DS des L1 que vous nous avez transmise où il a utilisé les mêmes molécules elle est censée être bonne puisqu'il est marqué que HBrO3 est AX4 et COCl2 AX3.
J'ai mal compris ou il y a une erreur quelque part ?
Merci d'avance pour votre aide
Dans cette question la proposition c) "HBrO3 sont de type AX4 et COCl2 est de type AX3" est comptée comme fausse dans la correction de Kaczmarek alors que d'après la correction du DS des L1 que vous nous avez transmise où il a utilisé les mêmes molécules elle est censée être bonne puisqu'il est marqué que HBrO3 est AX4 et COCl2 AX3.
J'ai mal compris ou il y a une erreur quelque part ?
Merci d'avance pour votre aide
yoyo- Messages : 67
Date d'inscription : 22/05/2020
 Re: Q12 CCB 2020-2021
Re: Q12 CCB 2020-2021
Salut 
Petite question à propos de ce QCM, pourquoi SoF4 est AX5 s'il vous plaît ?
Merci d'avance
Petite question à propos de ce QCM, pourquoi SoF4 est AX5 s'il vous plaît ?
Merci d'avance
1912- Messages : 251
Date d'inscription : 20/01/2020
 Re: Q12 CCB 2020-2021
Re: Q12 CCB 2020-2021
Je parlais de la question 12 du concours blanc des PACES. La question 12 reprend les molécules du DS des L1 mais les réponses ne coïncident pas, dans la correction que vous nous avez fournis de ce DS il est marqué que HBrO3 est AX4 et COCl2 est AX3 alors que içi la réponse c) est fausse d'après la correction du prof.
 [/url]
[/url]
 [/url]
[/url]
yoyo- Messages : 67
Date d'inscription : 22/05/2020
 Re: Q12 CCB 2020-2021
Re: Q12 CCB 2020-2021
Salut !
1912 :
Comme expliqué dans la correction du DS qu'on a fournie :
S : Z = 16 donc 1s2 2s2 2p6 3s2 3p4 → 6 électrons de valence
O : Z = 8 donc 1s2 2s2 2p4 → 6 électrons de valence
F : Z = 9 donc configuration électronique 1s2 2s2 2p5 → 7 électrons de valence
On a 1 S + 1 O + 4 × F soit un total de 6 + 6 + 4 × 7 = 40 électrons impliqués
→ On divise par 8 et on obtient 5, donc 5 liaisons et 0 doublet non liant, soit AX5
Et vérification :
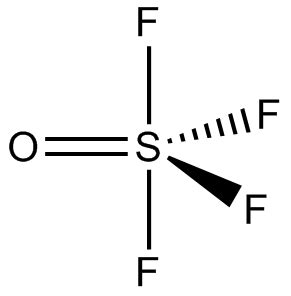
La molécule fait donc 5 liaisons et 0 doublet non liant, donc AX5E0 soit AX5
1912 :
Comme expliqué dans la correction du DS qu'on a fournie :
S : Z = 16 donc 1s2 2s2 2p6 3s2 3p4 → 6 électrons de valence
O : Z = 8 donc 1s2 2s2 2p4 → 6 électrons de valence
F : Z = 9 donc configuration électronique 1s2 2s2 2p5 → 7 électrons de valence
On a 1 S + 1 O + 4 × F soit un total de 6 + 6 + 4 × 7 = 40 électrons impliqués
→ On divise par 8 et on obtient 5, donc 5 liaisons et 0 doublet non liant, soit AX5
Et vérification :

La molécule fait donc 5 liaisons et 0 doublet non liant, donc AX5E0 soit AX5

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
1912 aime ce message
 Re: Q12 CCB 2020-2021
Re: Q12 CCB 2020-2021
yoyo : eh bien on pensait aussi que la configuration serait celle-ci, vu que la molécule s'écrit "HBrO3", ce qui laisse penser que le H es lié au Br... mais non, si l'on en croit internet et Kaczmarek, donc non, la molécule est bien AX3E1 et a la tête que Rick a dessinée plus haut 
1912 : la couche 4s est bien remplie avant la 3d, on respecte la règle de Klechkowski ! mais lorsqu'on écrit la configuration électronique, la plupart du temps on les remet dans l'ordre par n croissant (1, 2, 3, 4, etc) pour que ce soit plus simple
Bon courage à vous deux !
1912 : la couche 4s est bien remplie avant la 3d, on respecte la règle de Klechkowski ! mais lorsqu'on écrit la configuration électronique, la plupart du temps on les remet dans l'ordre par n croissant (1, 2, 3, 4, etc) pour que ce soit plus simple
Bon courage à vous deux !

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: Q12 CCB 2020-2021
Re: Q12 CCB 2020-2021
Pas de soucis !
Merci beaucoup pour ton aide
Merci beaucoup pour ton aide
1912- Messages : 251
Date d'inscription : 20/01/2020
 Re: Q12 CCB 2020-2021
Re: Q12 CCB 2020-2021
Salut !
La molécule OCS est polaire (donc pas apolaire), car le carbone est doublement lié à un O et un S, qui ont une électronégativité différente : O est très électronégatif, il va donc attirer à lui les électrons de la liaisons O=C, tandis que S a une électronégativité légèrement supérieure à C, il va donc attirer très peu les électrons de la liaison C=S
On a donc la présence d'un pôle négatif au niveau du O : la molécule est polaire.
Concernant MgCl2 :
le Z du Mg est 12, ce qui donne une config électronique 1s2 2s2 2p6 3s2, la couche de valence est la 3, donc 2 électrons de valence.
les Cl sont des halogènes, ils ont donc 7 électrons de valence et effectuent une liaison + 3 dnl
Donc le Mg est lié simplement (et non doublement) à chacun des 2 Cl
Donc au final ça donne Cl -- Mg -- Cl
La molécule est symétrique, chacun des chlores attire autant les électrons du Mg, donc on ne peut pas former de pôle + et - (la somme vectorielle des moments dipolaires est nulle, comme tu le disais).
Donc pas de rigidité lié à des doubles liaisons, simplement une symétrie qui annule les moments dipolaires !
J'espère que c'est plus claire pour toi, bon courage
La molécule OCS est polaire (donc pas apolaire), car le carbone est doublement lié à un O et un S, qui ont une électronégativité différente : O est très électronégatif, il va donc attirer à lui les électrons de la liaisons O=C, tandis que S a une électronégativité légèrement supérieure à C, il va donc attirer très peu les électrons de la liaison C=S
On a donc la présence d'un pôle négatif au niveau du O : la molécule est polaire.
Concernant MgCl2 :
le Z du Mg est 12, ce qui donne une config électronique 1s2 2s2 2p6 3s2, la couche de valence est la 3, donc 2 électrons de valence.
les Cl sont des halogènes, ils ont donc 7 électrons de valence et effectuent une liaison + 3 dnl
Donc le Mg est lié simplement (et non doublement) à chacun des 2 Cl
Donc au final ça donne Cl -- Mg -- Cl
La molécule est symétrique, chacun des chlores attire autant les électrons du Mg, donc on ne peut pas former de pôle + et - (la somme vectorielle des moments dipolaires est nulle, comme tu le disais).
Donc pas de rigidité lié à des doubles liaisons, simplement une symétrie qui annule les moments dipolaires !
J'espère que c'est plus claire pour toi, bon courage

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Sujets similaires
Sujets similaires» DS1 2020-2021 Q3
» CCB QCM 8 spe med maï 2020-2021
» CC 2020/2021 Q8 et Q9
» Ed 1 2020 2021
» DS 2 - q4 (2020-2021)
» CCB QCM 8 spe med maï 2020-2021
» CC 2020/2021 Q8 et Q9
» Ed 1 2020 2021
» DS 2 - q4 (2020-2021)
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2020-2021 (Contrôle continu et Concours)
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum