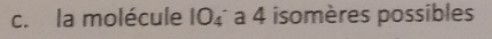QCM4 premier sujet PACES
3 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2020-2021 (Contrôle continu et Concours)
Page 1 sur 1
 Re: QCM4 premier sujet PACES
Re: QCM4 premier sujet PACES
Coucou je comprends pas comment on fait
yepaaaa- Messages : 92
Date d'inscription : 08/11/2020
 Re: QCM4 premier sujet PACES
Re: QCM4 premier sujet PACES
Coucou, j'ai mieux regarder, je sais toujours pas comment on fait pour trouver les isoméries, mais en revanche je trouve que l'iode a 3 doublets non liants (dans la colonne du chlore) donc pour moi il peut déjà pas faire 4 liaisons avec l'oxygène mais une seule.
donc pour moi c'est faux.
est ce que qqn peut confirmer mon raisonnement ?
donc pour moi c'est faux.
est ce que qqn peut confirmer mon raisonnement ?
yepaaaa- Messages : 92
Date d'inscription : 08/11/2020
 Re: QCM4 premier sujet PACES
Re: QCM4 premier sujet PACES
Salut !
Tout d'abord pour répondre à Nelly effectivement l'iode est un halogène, donc il fait normalement 1 liaison et 3 doublets non-liants. Cependant il peut être en situation d'hypervalence, ce qui lui permettra d'impliquer ses dnl dans des liaisons, donc la molécule IO4⁻ existe bien
Ensuite, pour savoir combien d'isomères possède la molécule, on commence par la dessiner.
Notre iode est un halogène, il a donc 7 électrons autour de lui.
Les oxygènes sont entourés de 6 électrons chacun.
Donc si on relie les électrons de l'iode à ceux des 4 oxygènes, on se retrouve avec notre I lié doublement à 3 O et simplement à 1 O.
L'iode n'a donc pas de doublet puisque tous ses électrons sont mobilisés dans des liaisons. En revanche, tous les oxygènes peuvent former 2 dnl. L'oxygène simplement lié portera en plus une charge moins (ou un 3e dnl), puisqu'il lui reste 2 électrons seuls.
Ce qui donne :

Donc sur cette image, on a le premier isomère.
Comme on a présence d'un système conjugué (alternance de dnl - sigma - pi), les électrons peuvent se délocaliser au sein de la molécule, et donc la charge moins se déplace.
Les 4 isomères correspondent aux différents emplacements possibles pour la charge - : sur le O du haut, sur le O du bas, sur le O de droite et sur le O de gauche.
La proposition est donc vraie !
J'espère avoir pu vous éclairer, bon courage à vous !
Tout d'abord pour répondre à Nelly effectivement l'iode est un halogène, donc il fait normalement 1 liaison et 3 doublets non-liants. Cependant il peut être en situation d'hypervalence, ce qui lui permettra d'impliquer ses dnl dans des liaisons, donc la molécule IO4⁻ existe bien
Ensuite, pour savoir combien d'isomères possède la molécule, on commence par la dessiner.
Notre iode est un halogène, il a donc 7 électrons autour de lui.
Les oxygènes sont entourés de 6 électrons chacun.
Donc si on relie les électrons de l'iode à ceux des 4 oxygènes, on se retrouve avec notre I lié doublement à 3 O et simplement à 1 O.
L'iode n'a donc pas de doublet puisque tous ses électrons sont mobilisés dans des liaisons. En revanche, tous les oxygènes peuvent former 2 dnl. L'oxygène simplement lié portera en plus une charge moins (ou un 3e dnl), puisqu'il lui reste 2 électrons seuls.
Ce qui donne :

Donc sur cette image, on a le premier isomère.
Comme on a présence d'un système conjugué (alternance de dnl - sigma - pi), les électrons peuvent se délocaliser au sein de la molécule, et donc la charge moins se déplace.
Les 4 isomères correspondent aux différents emplacements possibles pour la charge - : sur le O du haut, sur le O du bas, sur le O de droite et sur le O de gauche.
La proposition est donc vraie !
J'espère avoir pu vous éclairer, bon courage à vous !

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: QCM4 premier sujet PACES
Re: QCM4 premier sujet PACES
super merci bcp pour ton explication !

yepaaaa- Messages : 92
Date d'inscription : 08/11/2020
Asticoo aime ce message
 Sujets similaires
Sujets similaires» QCM7 premier sujet PACES
» QCM 38 SUJET PACES 2020
» PACES SUJET 1 Question 22 Dr Deckmyn
» TK2 QCM4
» QCM4 spé Med mai
» QCM 38 SUJET PACES 2020
» PACES SUJET 1 Question 22 Dr Deckmyn
» TK2 QCM4
» QCM4 spé Med mai
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2020-2021 (Contrôle continu et Concours)
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum