TK1 2013 Ordre de liaison et carbone 12.
+2
Akarinac
sadek
6 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: CHIMIE STRUCTURALE :: TK & Tutos 2013-2014
Page 1 sur 1
 TK1 2013 Ordre de liaison et carbone 12.
TK1 2013 Ordre de liaison et carbone 12.
Bonjour,
Après un premier tutorat où nous avons corrigé le premier talc khôles, j'ai certains problèmes sur plusieurs questions.
Je ne savais pas si je devais faire un post par question, alors excusez-moi si je devais..
Une question est:
Soit le diagramme d'énergie moléculaire de la molécule H-Cl (on négligera le niveau 3s²) une/plusieurs réponses sont bonnes:
A. l'ordre de liaison est de 1
B. l'ordre de liaison est de 2
C.on obtient 2 orbitales anti-liantes
D.on obtient 1 orbitale liante
E.on obtient 3 orbitales liantes
J'aurais répondu C-D, mais nous avons mis en tutorat que c'était A et D.
Je ne comprends pas pourquoi la C n'est pas bonne, et pas non plus comment on a calculé l'ordre de liaison.
Personnellement, j'ai 2e- de l'orbitale liante (1 e- de H et 1 de Cl) et 4 autres qui forment des non liantes (naturelles puisqu'elles proviennent que de Cl), ce qui fait ordre de liaison= ( 2- 4) /2 = -2 ???
Et, l'autre question était:
Quelle est LA proposition juste:
A. Le carbone 12 possède 12 protons et 12e-
B. Le carbone 12 et le carbone 14 sont isobares
C. Le nombre de masse du carbone 14 est identique à celui du carbone 12
D. Un atome chargé négativement a moins d'e- que le même atome neutre
E. Aucune réponse bonne
On a vu que la réponse était C,alors que j'aurais dis la E. Est-ce une erreur de recopiage de ma part??
Merci beaucoup d'avance, et pardon du post un peu long.
Vincent
Après un premier tutorat où nous avons corrigé le premier talc khôles, j'ai certains problèmes sur plusieurs questions.
Je ne savais pas si je devais faire un post par question, alors excusez-moi si je devais..
Une question est:
Soit le diagramme d'énergie moléculaire de la molécule H-Cl (on négligera le niveau 3s²) une/plusieurs réponses sont bonnes:
A. l'ordre de liaison est de 1
B. l'ordre de liaison est de 2
C.on obtient 2 orbitales anti-liantes
D.on obtient 1 orbitale liante
E.on obtient 3 orbitales liantes
J'aurais répondu C-D, mais nous avons mis en tutorat que c'était A et D.
Je ne comprends pas pourquoi la C n'est pas bonne, et pas non plus comment on a calculé l'ordre de liaison.
Personnellement, j'ai 2e- de l'orbitale liante (1 e- de H et 1 de Cl) et 4 autres qui forment des non liantes (naturelles puisqu'elles proviennent que de Cl), ce qui fait ordre de liaison= ( 2- 4) /2 = -2 ???
Et, l'autre question était:
Quelle est LA proposition juste:
A. Le carbone 12 possède 12 protons et 12e-
B. Le carbone 12 et le carbone 14 sont isobares
C. Le nombre de masse du carbone 14 est identique à celui du carbone 12
D. Un atome chargé négativement a moins d'e- que le même atome neutre
E. Aucune réponse bonne
On a vu que la réponse était C,alors que j'aurais dis la E. Est-ce une erreur de recopiage de ma part??
Merci beaucoup d'avance, et pardon du post un peu long.
Vincent

sadek- Messages : 265
Date d'inscription : 03/10/2013
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Bonjour, je suis tout comme toi en PACES, mais je peux tout de même essayer de répondre à ta première question, étant donné que la personne l'ayant corrigé en tutorat pour notre groupe l'a plutôt bien détaillé.
Il y a effectivement 1 électron à placer du coté du H, et 5 à placer du coté du Cl, mais étant donné qu'il n'y a justement qu'un seul électron en H, seul un des électrons du Cl va interagir avec celui-ci pour former la liaison. On aura donc un doublet d'électron sur l'orbitale sigma, et deux doublet sur la ligne des non-liants, au milieu. Attention, il ne faut pas confondre les non-liants ( placés au milieu ) et les anti-liants ( placés en π* et sigma* ). Ici, on aura donc bien un ordre de liaison de 1 ( car le calcul est : (2-0)/2=1 ), et il n'y aura donc pas deux orbitales anti-liantes mais deux orbitales non-liantes.
Pour la deuxième question, je peux pas te dire, on l'a pas corrigée et j'aurais mis la même chose que toi.
En espérant avoir été clair, même si j'ai dû faire des erreurs d'emploi du vocabulaire. Bonne journée .
.
Il y a effectivement 1 électron à placer du coté du H, et 5 à placer du coté du Cl, mais étant donné qu'il n'y a justement qu'un seul électron en H, seul un des électrons du Cl va interagir avec celui-ci pour former la liaison. On aura donc un doublet d'électron sur l'orbitale sigma, et deux doublet sur la ligne des non-liants, au milieu. Attention, il ne faut pas confondre les non-liants ( placés au milieu ) et les anti-liants ( placés en π* et sigma* ). Ici, on aura donc bien un ordre de liaison de 1 ( car le calcul est : (2-0)/2=1 ), et il n'y aura donc pas deux orbitales anti-liantes mais deux orbitales non-liantes.
Pour la deuxième question, je peux pas te dire, on l'a pas corrigée et j'aurais mis la même chose que toi.
En espérant avoir été clair, même si j'ai dû faire des erreurs d'emploi du vocabulaire. Bonne journée
Akarinac- Messages : 1
Date d'inscription : 03/10/2013
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Pour le diagramme d'énergie de H-Cl

Il ne faut pas confondre les orbitales non liantes et anti-liantes.
Les non liantes n'interviennent pas dans la liaison et donc dans l'ordre de laison, elles ont, ici le même niveaux d'énergie que la couche 2p de Cl.
Pour la 2eme questions,
c'est bien la réponse E et la C est fausse.

Il ne faut pas confondre les orbitales non liantes et anti-liantes.
Les non liantes n'interviennent pas dans la liaison et donc dans l'ordre de laison, elles ont, ici le même niveaux d'énergie que la couche 2p de Cl.
Pour la 2eme questions,
c'est bien la réponse E et la C est fausse.
Kevin B- Messages : 25
Date d'inscription : 18/11/2012
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Merci beaucoup Akarinac et Kevin B c'est parfait maintenant
Bon week end;)
Bon week end;)

sadek- Messages : 265
Date d'inscription : 03/10/2013
 encore un petit problème..
encore un petit problème..
Désolé mais à la question suivante, on nous demande le diagramme moléculaire de N-O. Et la réponse donnée par la correction est D : "On obtient 3 orbitales anti-liante".
Or d'après le schéma je n'en trouve que 2:
- 1 AL de la mise en commun des 2s² sigma *
- 1 AL la couche pi * qui ne contient qu'un electron au niveau de la mise en commun des 2p
(Excusez moi si la réponse est ridicule mais en tous cas je ne vois vraiment pas!)
Or d'après le schéma je n'en trouve que 2:
- 1 AL de la mise en commun des 2s² sigma *
- 1 AL la couche pi * qui ne contient qu'un electron au niveau de la mise en commun des 2p
(Excusez moi si la réponse est ridicule mais en tous cas je ne vois vraiment pas!)

sadek- Messages : 265
Date d'inscription : 03/10/2013
 diagramme NO
diagramme NO
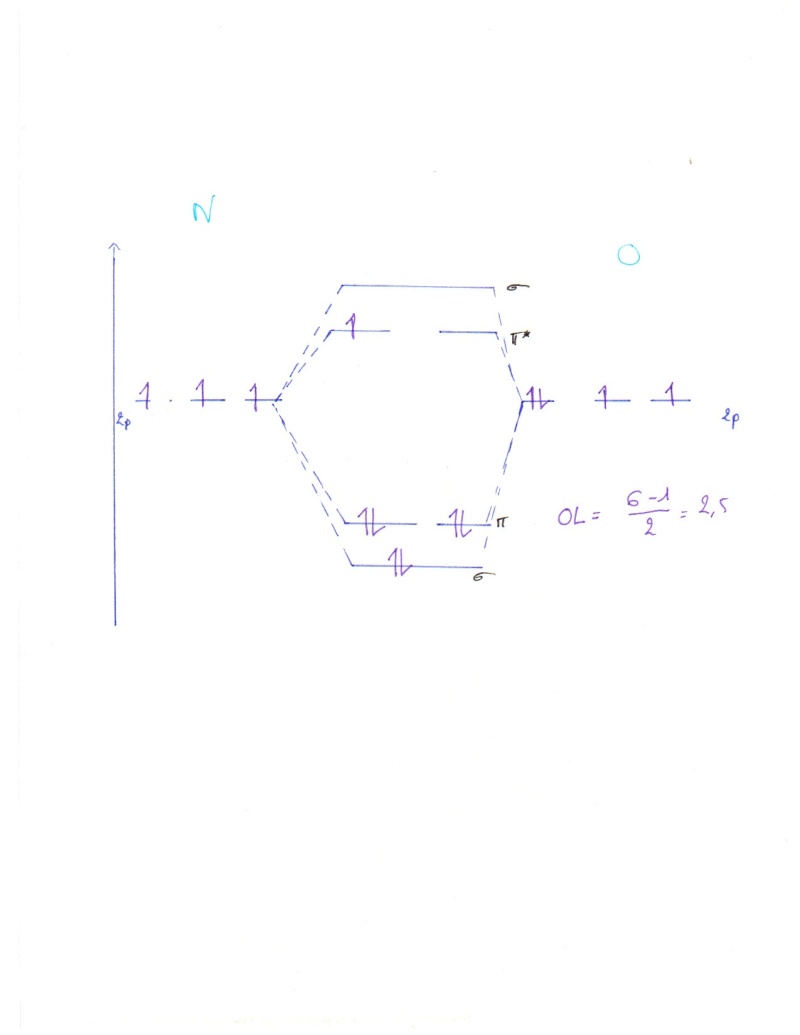
Pour le diagramme NO :
on aurait du le préciser mais on néglige la couche 2s

 " />
" />
Pour N et O ont a 3 orbitales atomiques pour chaque atome, donc 6 orbitales au total, on aura 6 orbitales moléculaires, 3 liantes 3 anti liantes, (on a des non liante quand on a pas autant d'orbital pour chaque atome.
Après on remplis les couches atomique en commençant par la couche la moins énergétique sigma, ensuite Pi (en respectant le principe de Hund d'abord 1 électrons dans chaque case puis 2...)
on aurait du le préciser mais on néglige la couche 2s
 " />
" />Pour N et O ont a 3 orbitales atomiques pour chaque atome, donc 6 orbitales au total, on aura 6 orbitales moléculaires, 3 liantes 3 anti liantes, (on a des non liante quand on a pas autant d'orbital pour chaque atome.
Après on remplis les couches atomique en commençant par la couche la moins énergétique sigma, ensuite Pi (en respectant le principe de Hund d'abord 1 électrons dans chaque case puis 2...)
Kevin B- Messages : 25
Date d'inscription : 18/11/2012
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Donc faire le diagramme ne nous aide pas à répondre à la question du coup?
Parce qu'avec celui de H Cl c'était le cas..
Parce qu'avec celui de H Cl c'était le cas..

sadek- Messages : 265
Date d'inscription : 03/10/2013
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
bonjour
Dans le diagramme O-N que tu viens de faire comment on peut savoir si le dernier électrons est en anti liant ou en non liant ? Parce que pour moi quand il n'y a pas le même nombre d'électron sur la couche p, les derniers "en trop" sont en non liant
Merci!
Dans le diagramme O-N que tu viens de faire comment on peut savoir si le dernier électrons est en anti liant ou en non liant ? Parce que pour moi quand il n'y a pas le même nombre d'électron sur la couche p, les derniers "en trop" sont en non liant
Merci!
choukette- Messages : 53
Date d'inscription : 20/10/2012
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Coucou!
Je crois surtout que dans le cas de la liaison H-Cl c'est un cas particulier, qui correspondrait, selon le tuteur de chimie qui nous a expliqué ça, à la grande différence dans les configurations entre H (1s1) et CL (3p5) ...
Ceci expliquerai que dans le diagramme de H-Cl on ait des orbitales non liantes (et pas anti liantes).
En revanche, dans la deuxième question, l'électron célibataire va bien en orbitale anti liante.
Je crois surtout que dans le cas de la liaison H-Cl c'est un cas particulier, qui correspondrait, selon le tuteur de chimie qui nous a expliqué ça, à la grande différence dans les configurations entre H (1s1) et CL (3p5) ...
Ceci expliquerai que dans le diagramme de H-Cl on ait des orbitales non liantes (et pas anti liantes).
En revanche, dans la deuxième question, l'électron célibataire va bien en orbitale anti liante.

Numérobis- Messages : 8
Date d'inscription : 17/09/2013
Age : 29
Localisation : Lille
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Bonjour tout le monde 
Choukette, pour construire un diagramme il faut considérer les orbitales et non les électrons,
je m'explique;
-> si tu as "équivalence" d'orbitales entre les deux atomes par exemple s-s / p-p /d-d tu construis le diagramme de "base" avec sigma/anti-sigma, pi/anti-pi
-> par contre si tu n'as pas "équivalence" d'orbitales (autrement dit que l'orbitale d'un atome n'a pas sa copine de l'autre coté) tu vas avoir des orbitales non liantes qui sont dues aux orbitales qui n'ont pas de copines...
Tu auras donc le cas dans une liaisons avec mise en commun:
soit la sous-couche s avec une p (1 équivalence=> sigma/anti sigma, il reste 2 orbitales p sans copine=> les 2 non liantes)
soit p avec d (3 équivalences => sigma/anti-sigma + les 2 pi/anit-pi, et 2 sans copines => 2 non liantes)
ou s avec d et ainsi de suite, en se basant sur le même principe
ou encore s avec rien du tout! cf la couche 2s2 du Cl dans H-Cl n'intervient pas en soit dans la liaison proprement parlé (la sous-couche 1s de l'H 'se liant' avec la sous-couche 2p du Cl) mais elle existe belle et bien et forme une fois remplie le 3ème doublet non liant qu'on connait autour des halogènes ... cf représentation de Lewis
Quand je parle "d'équivalence" il s'agit de 1 orbitale qui a sa "copine" chez le 2ème atome de la liaison (autrement dit 2 orbitales atomiques chacune appartenant à un atome de la liaison)
Le diagramme étant ainsi fait, il ne te reste plus qu'à le remplir d'électrons en respectant les règles de Pauli et Hund , en commençant par le niveau énergétique le plus bas!
Dans le cadre du NO tu as à chaque fois "équivalence" au niveau des orbitales, tu bâtis ton diagramme (sigma/anti-sigma, les 2 pi/anti-pi)
tu remplis d'électrons et tu vois donc bien que le dernier électron 'ratterri' en anti-pi (que tu vois dans le diagramme de Kevin [par contre je l'aurais plus mis dans l'anti-pi proche de l'O, l'O donnant cet électron... :-D ]
L'Ordre de Liaison (OL) de 2,5 veut dire que:
1) la liaison existe OL>0
2) il y a une double liaison OL=2
3) que cette double liaison peut parfois être triplet par effet mésomère OL= X,5 (lui même expliqué par le déplacement d'un doublet non liant de l'oxygène sur la double liaison initiale, ou par le doublet non liant du N qui bouge sur la double liaison, cf mésomérie)
En espérant ne pas vous avoir perdu ;-)
Des bisous et du courage!
Choukette, pour construire un diagramme il faut considérer les orbitales et non les électrons,
je m'explique;
-> si tu as "équivalence" d'orbitales entre les deux atomes par exemple s-s / p-p /d-d tu construis le diagramme de "base" avec sigma/anti-sigma, pi/anti-pi
-> par contre si tu n'as pas "équivalence" d'orbitales (autrement dit que l'orbitale d'un atome n'a pas sa copine de l'autre coté) tu vas avoir des orbitales non liantes qui sont dues aux orbitales qui n'ont pas de copines...
Tu auras donc le cas dans une liaisons avec mise en commun:
soit la sous-couche s avec une p (1 équivalence=> sigma/anti sigma, il reste 2 orbitales p sans copine=> les 2 non liantes)
soit p avec d (3 équivalences => sigma/anti-sigma + les 2 pi/anit-pi, et 2 sans copines => 2 non liantes)
ou s avec d et ainsi de suite, en se basant sur le même principe
ou encore s avec rien du tout! cf la couche 2s2 du Cl dans H-Cl n'intervient pas en soit dans la liaison proprement parlé (la sous-couche 1s de l'H 'se liant' avec la sous-couche 2p du Cl) mais elle existe belle et bien et forme une fois remplie le 3ème doublet non liant qu'on connait autour des halogènes ... cf représentation de Lewis
Quand je parle "d'équivalence" il s'agit de 1 orbitale qui a sa "copine" chez le 2ème atome de la liaison (autrement dit 2 orbitales atomiques chacune appartenant à un atome de la liaison)
Le diagramme étant ainsi fait, il ne te reste plus qu'à le remplir d'électrons en respectant les règles de Pauli et Hund , en commençant par le niveau énergétique le plus bas!
Dans le cadre du NO tu as à chaque fois "équivalence" au niveau des orbitales, tu bâtis ton diagramme (sigma/anti-sigma, les 2 pi/anti-pi)
tu remplis d'électrons et tu vois donc bien que le dernier électron 'ratterri' en anti-pi (que tu vois dans le diagramme de Kevin [par contre je l'aurais plus mis dans l'anti-pi proche de l'O, l'O donnant cet électron... :-D ]
L'Ordre de Liaison (OL) de 2,5 veut dire que:
1) la liaison existe OL>0
2) il y a une double liaison OL=2
3) que cette double liaison peut parfois être triplet par effet mésomère OL= X,5 (lui même expliqué par le déplacement d'un doublet non liant de l'oxygène sur la double liaison initiale, ou par le doublet non liant du N qui bouge sur la double liaison, cf mésomérie)
En espérant ne pas vous avoir perdu ;-)
Des bisous et du courage!

Dudu- Messages : 145
Date d'inscription : 10/09/2011
Age : 32
 Re: TK1 2013 Ordre de liaison et carbone 12.
Re: TK1 2013 Ordre de liaison et carbone 12.
Oui c'est beaucoup plus clair merci beaucoup :-)
choukette- Messages : 53
Date d'inscription : 20/10/2012
 Sujets similaires
Sujets similaires» Ordre de liaison
» Ordre de liaison
» Ordre de liaison
» Ordre de liaison
» ordre de priorite c asymetrique
» Ordre de liaison
» Ordre de liaison
» Ordre de liaison
» ordre de priorite c asymetrique
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des Talc-Khôlles (TK) et des tutorats :: CHIMIE STRUCTURALE :: TK & Tutos 2013-2014
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum