enthalpie
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
 enthalpie
enthalpie
Bonsoir,
dans un ED, on nous demande de calculer une enthalpie standard de réaction pour une température de 650 K je voulais donc savoir quels changements implique la température dans le calcul de l'enthalpie.
Et puis aussi de quelle manière on calcule une enthalpie d'oxydation à partir d'une enthalpie de combustion.
Voilà merci
dans un ED, on nous demande de calculer une enthalpie standard de réaction pour une température de 650 K je voulais donc savoir quels changements implique la température dans le calcul de l'enthalpie.
Et puis aussi de quelle manière on calcule une enthalpie d'oxydation à partir d'une enthalpie de combustion.
Voilà merci
Lucie H- Messages : 1
Date d'inscription : 25/10/2013
 Re: enthalpie
Re: enthalpie
Salut Lucie,
concernant ta 1ere question: L'enthalpie correspond a l’ énergie totale d'un système. Ton enthalpie tient donc compte de l’énergie interne, de la pression et du volume définis lors de la réaction. L’énergie interne U correspond elle même au dégagement de chaleur et au travail échangés pendant la réaction.
Le fait de modifier la température va donc avoir une influence sur l'enthalpie de ta réaction.
Il suffit après de quantifier cette influence grâce a la capacité calorifique
Dans un exercice pour trouver l’enthalpie a 650K, il faut que tu ajoute la capacité calorifique des produits moins celle des réactifs a l'enthalpie de réaction a 298K.
Les ED sont écrits par le Pr Gautret, il me semble, et je ne pense pas que Boury posera ce genre de question a l'examen
Pour ta 2eme question, j'utilise toujours la même technique, je commence par écrire l’équation dont on demande l'enthalpie.
J’écris donc la réaction d 'oxydation. Ensuite j'ecris les equation de combustions des elements de chaque coté de l’équation et j'arrive a terminer le cycle de Hess.
petit exemple de l'ED de l'année dernière :
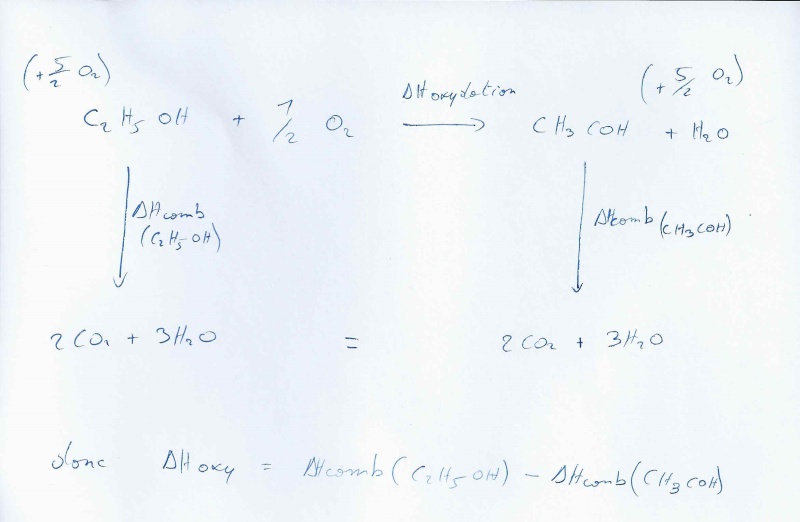
concernant ta 1ere question: L'enthalpie correspond a l’ énergie totale d'un système. Ton enthalpie tient donc compte de l’énergie interne, de la pression et du volume définis lors de la réaction. L’énergie interne U correspond elle même au dégagement de chaleur et au travail échangés pendant la réaction.
Le fait de modifier la température va donc avoir une influence sur l'enthalpie de ta réaction.
Il suffit après de quantifier cette influence grâce a la capacité calorifique
Dans un exercice pour trouver l’enthalpie a 650K, il faut que tu ajoute la capacité calorifique des produits moins celle des réactifs a l'enthalpie de réaction a 298K.
Les ED sont écrits par le Pr Gautret, il me semble, et je ne pense pas que Boury posera ce genre de question a l'examen
Pour ta 2eme question, j'utilise toujours la même technique, je commence par écrire l’équation dont on demande l'enthalpie.
J’écris donc la réaction d 'oxydation. Ensuite j'ecris les equation de combustions des elements de chaque coté de l’équation et j'arrive a terminer le cycle de Hess.
petit exemple de l'ED de l'année dernière :

Marco- Messages : 13
Date d'inscription : 05/11/2012
 Sujets similaires
Sujets similaires» Enthalpie / Enthalpie Libre
» Exo d'appli sur l'Enthalpie
» enthalpie
» Enthalpie H20
» Enthalpie - TK 3
» Exo d'appli sur l'Enthalpie
» enthalpie
» Enthalpie H20
» Enthalpie - TK 3
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum