Nombre d'électrons par orbitale
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
 Nombre d'électrons par orbitale
Nombre d'électrons par orbitale
Salut je suis bloquée chimie car si j'avais bien compris sur la sous-couche p par exemple il pouvait y avoir 6 electrons maximum mais le prof a dit en cours et c'est aussi dit par le principe d'exclusion de Pauli qu'une orbitale ne peut pas avoir plus de 2 électrons. Donc je comprends pas bien comment la sous couche p par exemple peut avoir 6 électrons.
lilaaaaaa- Messages : 81
Date d'inscription : 29/08/2023
 Nombre d'éléctrons par orbitale
Nombre d'éléctrons par orbitale
Salut paola,
1) effectivement le principe de Pauli te précise bien que des électrons au sein d'une meme configuration éléctronique ont forcément un de leur nombre quantique qui diffère et tu pouvais déduire de ca qu'effectivement une orbitale atomique possède au maximum deux éléctrons ayant au moins un nombre quantique qui est différent.
2) Concernant les orbitales atomiques:
2s et 2p6 peuvent se lire de cette manière aussi: n= 2 ; l = 0,1 ; ml=-1,0,1 pour l= 1 et ml=0 pour l=0 car ml prend toutes les valeurs de -l à +l, ms peu importe.
Ainsi, on obtient ça:
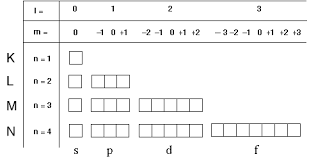
Tu observes bien que dans chaque orbitale atomique (ici case atomique c'est pareil) on peut mettre uniquement 2 éléctrons.
Tu peux remarquer aussi que dans la sous couche p de la deuxieme couche il y a 3 cases atomiques dans lesquelles tu peux mettre uniquement que 2 éléctrons soit 2x3=6 éléctrons, d'ou 2p6 quand elle est remplie au maximum.
n c'est ton nombre de couche (K;L;M;N)
l c'est ta sous couche ici p (s;p;d;f)
ml c'est le nombre de case atomique ici ml= -1,0,1 (2px,2py,2pz)
n'hésites pas si tu as d'autres questions
1) effectivement le principe de Pauli te précise bien que des électrons au sein d'une meme configuration éléctronique ont forcément un de leur nombre quantique qui diffère et tu pouvais déduire de ca qu'effectivement une orbitale atomique possède au maximum deux éléctrons ayant au moins un nombre quantique qui est différent.
2) Concernant les orbitales atomiques:
2s et 2p6 peuvent se lire de cette manière aussi: n= 2 ; l = 0,1 ; ml=-1,0,1 pour l= 1 et ml=0 pour l=0 car ml prend toutes les valeurs de -l à +l, ms peu importe.
Ainsi, on obtient ça:

Tu observes bien que dans chaque orbitale atomique (ici case atomique c'est pareil) on peut mettre uniquement 2 éléctrons.
Tu peux remarquer aussi que dans la sous couche p de la deuxieme couche il y a 3 cases atomiques dans lesquelles tu peux mettre uniquement que 2 éléctrons soit 2x3=6 éléctrons, d'ou 2p6 quand elle est remplie au maximum.
n c'est ton nombre de couche (K;L;M;N)
l c'est ta sous couche ici p (s;p;d;f)
ml c'est le nombre de case atomique ici ml= -1,0,1 (2px,2py,2pz)
n'hésites pas si tu as d'autres questions
Charles64fr- Messages : 73
Date d'inscription : 14/02/2023
Age : 20
lilaaaaaa aime ce message
 Sujets similaires
Sujets similaires» nombre quantique
» orbitale moleculaire
» CK et nombre d'ATP
» Orbitale Moléculaire liante et non liante
» nombre d'introns
» orbitale moleculaire
» CK et nombre d'ATP
» Orbitale Moléculaire liante et non liante
» nombre d'introns
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum