Nombre d'oxydation
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
 Nombre d'oxydation
Nombre d'oxydation
Bonjour, 
J'ai un petit problème à propos des deux méthodes pour trouver le nombre d'oxydation des atomes...


Sur la plupart des molécules, je n'ai pas de soucis, mais je suis tombée sur le cas de S2O3 2- (voir sur la photo).
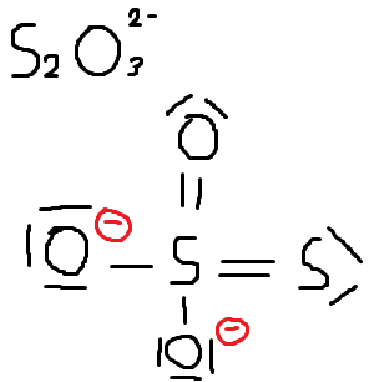
Si l'image marche, vous avez vu que j'ai tenté de trouver le schéma de Lewis de la molécule que j'espère correct...
J'ai du mal avec le Nombre d'Oxydation de S (comme NO(O) = -II sauf dans le cas d'un péroxyde, je sais qu'ici NO(O) = -II).
Avec la méthode "calcul", j'obtient :
3NO(O)+2NO(S)= -2 <=> 3*(-2) + 2(NO) = -2 <=> -6 + 2NO(S) = -2+6 <=> 2NO(S) = 4 <=> NO(S) = 2 donc NO(S) = II
Mais avec le schéma de Lewis, je vois que pour le S de droite, on à NO(S) = 0 et que pour le S du centre on à NO(S)= IV ...
Alors je ne sait pas à quoi me fier ; faut t'il faire une moyenne des NO de chaque S ?

Comment faire pour calculer les NO avec le schéma de Lewis si les NO diffèrent comme dans mon exemple ?
Merci de votre aide

J'ai un petit problème à propos des deux méthodes pour trouver le nombre d'oxydation des atomes...
Sur la plupart des molécules, je n'ai pas de soucis, mais je suis tombée sur le cas de S2O3 2- (voir sur la photo).
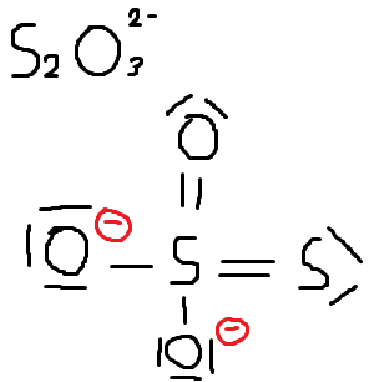
Si l'image marche, vous avez vu que j'ai tenté de trouver le schéma de Lewis de la molécule que j'espère correct...
J'ai du mal avec le Nombre d'Oxydation de S (comme NO(O) = -II sauf dans le cas d'un péroxyde, je sais qu'ici NO(O) = -II).
Avec la méthode "calcul", j'obtient :
3NO(O)+2NO(S)= -2 <=> 3*(-2) + 2(NO) = -2 <=> -6 + 2NO(S) = -2+6 <=> 2NO(S) = 4 <=> NO(S) = 2 donc NO(S) = II
Mais avec le schéma de Lewis, je vois que pour le S de droite, on à NO(S) = 0 et que pour le S du centre on à NO(S)= IV ...
Alors je ne sait pas à quoi me fier ; faut t'il faire une moyenne des NO de chaque S ?


Comment faire pour calculer les NO avec le schéma de Lewis si les NO diffèrent comme dans mon exemple ?
Merci de votre aide
Emma_ro- Messages : 16
Date d'inscription : 14/09/2023
Age : 19
Localisation : 94
Emploi/loisirs : Etudiante en médecine
 Nombre d'oxydation
Nombre d'oxydation
Hello !
Bien vu ! On pourrait dire ici que tu fais fasses à un cas particulier.
Tu as essayé les deux méthodes pour comparer, bravo tu essayes d'aller plus loin.
Pour pas que tu t'embrouilles je te fais un rappel et je t'explique après cette molécule:
Comme on a vu il y a bien deux méthodes:
Méthode 1: LEWIS
Méthode 2: Algébrique
Méthode1: molécule + ou - complexe mais assez rapide et à utiliser sur des molécules simples.
Excepetion: A utiliser si peroxyde ou hydrure dans la molécule. Ex: H202 ou S2O82- (molécule complexe) où là avec la méthode algébique il n'est pas évident de se dire tiens ici NO (O) = -I
Méthode 2: Molécule + complexe où l'on connait tout les NO sauf celui de l'atome que l'on cherche.
Ici tu as une molécule complexe sans peroxyde, donc je pars sur l'algèbre: méthode 2
Tu obtiens effectivement NO (S) = + II
Il s'agit effectivement d'une moyenne entre les NO de tes deux soufres.
1054 BULLETIN DE L'UNION DES PHYSICIENS
( parle de cet ion thiosulfate)
L’application des deux parties de la règle rappelée précédemment conduit dans ces conditions (“) à attribuer à l’atome de soufre central le nombre d’oxydation IV et 0 (zéro) à l’atome de soufre qui lui est lié. La moyenne arithmétique II.
Bon courage, et bravo pour ta réflexion
N'hésites pas pour d'autres questions.
Bien vu ! On pourrait dire ici que tu fais fasses à un cas particulier.
Tu as essayé les deux méthodes pour comparer, bravo tu essayes d'aller plus loin.
Pour pas que tu t'embrouilles je te fais un rappel et je t'explique après cette molécule:
Comme on a vu il y a bien deux méthodes:
Méthode 1: LEWIS
Méthode 2: Algébrique
Méthode1: molécule + ou - complexe mais assez rapide et à utiliser sur des molécules simples.
Excepetion: A utiliser si peroxyde ou hydrure dans la molécule. Ex: H202 ou S2O82- (molécule complexe) où là avec la méthode algébique il n'est pas évident de se dire tiens ici NO (O) = -I
Méthode 2: Molécule + complexe où l'on connait tout les NO sauf celui de l'atome que l'on cherche.
Ici tu as une molécule complexe sans peroxyde, donc je pars sur l'algèbre: méthode 2
Tu obtiens effectivement NO (S) = + II
Il s'agit effectivement d'une moyenne entre les NO de tes deux soufres.
1054 BULLETIN DE L'UNION DES PHYSICIENS
( parle de cet ion thiosulfate)
L’application des deux parties de la règle rappelée précédemment conduit dans ces conditions (“) à attribuer à l’atome de soufre central le nombre d’oxydation IV et 0 (zéro) à l’atome de soufre qui lui est lié. La moyenne arithmétique II.
Bon courage, et bravo pour ta réflexion
N'hésites pas pour d'autres questions.
Charles64fr- Messages : 73
Date d'inscription : 14/02/2023
Age : 20
Emma_ro aime ce message
 Nombre d'oxydation (fin)
Nombre d'oxydation (fin)
Je comprends mieux ! Merci beaucoup 

Emma_ro- Messages : 16
Date d'inscription : 14/09/2023
Age : 19
Localisation : 94
Emploi/loisirs : Etudiante en médecine
Charles64fr aime ce message
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum