Nombre d'oxydation
2 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
 Nombre d'oxydation
Nombre d'oxydation
Bonjour,
J'aimerai connaitre la méthode pour trouver le nombre d'oxydation dans une molécule comme celles ci par exemple :
1) CH3-CO-CH2-CH3
2) H3C-C=O
3) NH-CH3
En fait je suis perdue car je ne voit pas quel serait le "nombre final total" quand on a des molécules ..
Merci de votre aide
J'aimerai connaitre la méthode pour trouver le nombre d'oxydation dans une molécule comme celles ci par exemple :
1) CH3-CO-CH2-CH3
2) H3C-C=O
3) NH-CH3
En fait je suis perdue car je ne voit pas quel serait le "nombre final total" quand on a des molécules ..
Merci de votre aide
Tia- Messages : 177
Date d'inscription : 16/10/2017
 Re: Nombre d'oxydation
Re: Nombre d'oxydation
Salut !
Le plus simple pour déterminer des nombres d'oxydation, c'est de dessiner ta molécule en formule développée, puis d'y représenter les effets donneurs et attracteurs, en sachant que la somme des nombres d'oxydation de chaque atome est égale à la charge de la molécule (dans tes trois exemples les molécules ne sont pas chargées, donc la somme des nombres d'oxydation sera égale à 0).
On va regarder ensemble tes deux premiers exemples :
1) Si tu représentes la molécule en forme développée tu obtiens ça :
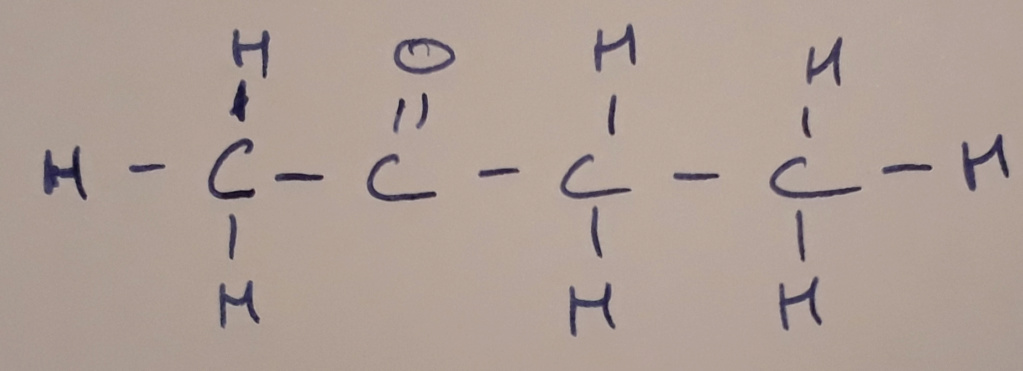
Sachant que l'oxygène est un élément électronégatif, il va attirer les électrons à lui. De plus, il est relié au carbone par une double liaison.
-> Il va donc attirer 2 électrons
L'hydrogène quand a lui a plutôt tendance à être un donneur lorsqu'il est relié à des non-métaux.
-> Il va donc donner 1 électron
De là, tu peux dire que l'oxygène aura pour nombre d'oxydation -II et l'hydrogène +I
Ensuite, tu détermines le nombre d'oxydation de chaque carbone à partir du nombre d'électron qui lui sont donnés ou pris :
- Le premier carbone reçoit 3 électrons (1 par liaison avec un hydrogène), il sera donc en -III
- Le deuxième carbone perd 2 électrons, il sera donc en +II
- Le troisième carbone reçoit 2 électrons, il sera donc -II
- Le quatrième carbone reçoit 3 électrons, il sera donc en -III
Ce qui donne :
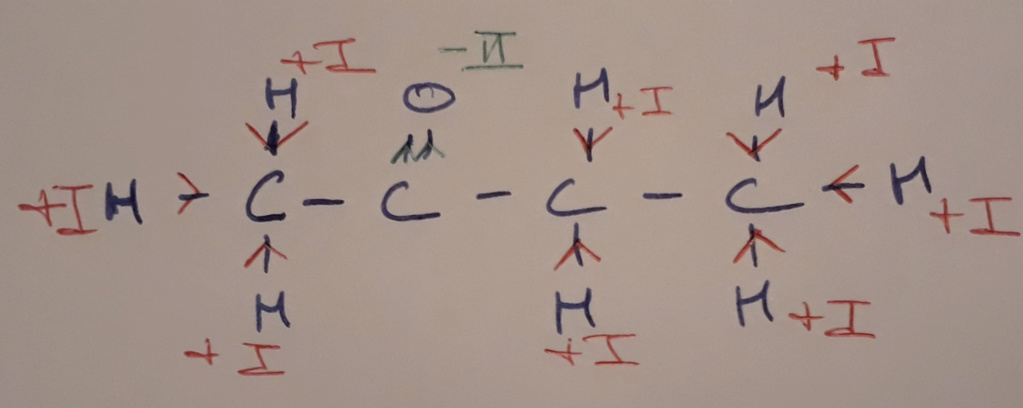
Et on constate que le total de tous les nombre d'oxydation est bien égal à 0
2) La molécule en forme développée :
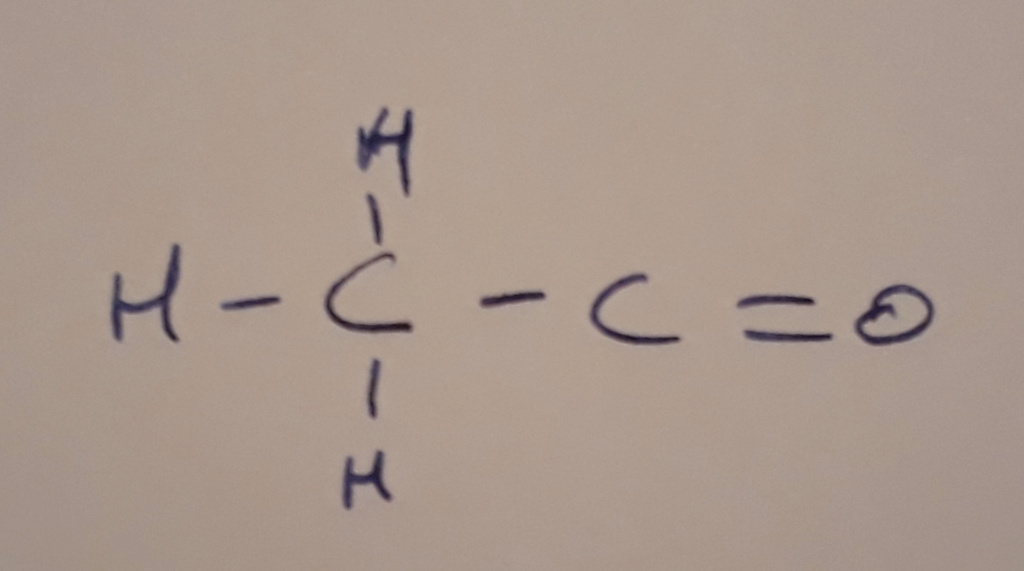
Ici, tu as encore un oxygène relié à un carbone par une double liaison, il va donc attirer à lui 2 électrons et sera en -II.
Les hydrogènes donnent chacun un électron au carbone qui les porte, il seront tous en +I
Le premier carbone sera alors en -III (il reçoit 3 électrons), et le deuxième carbone en +II
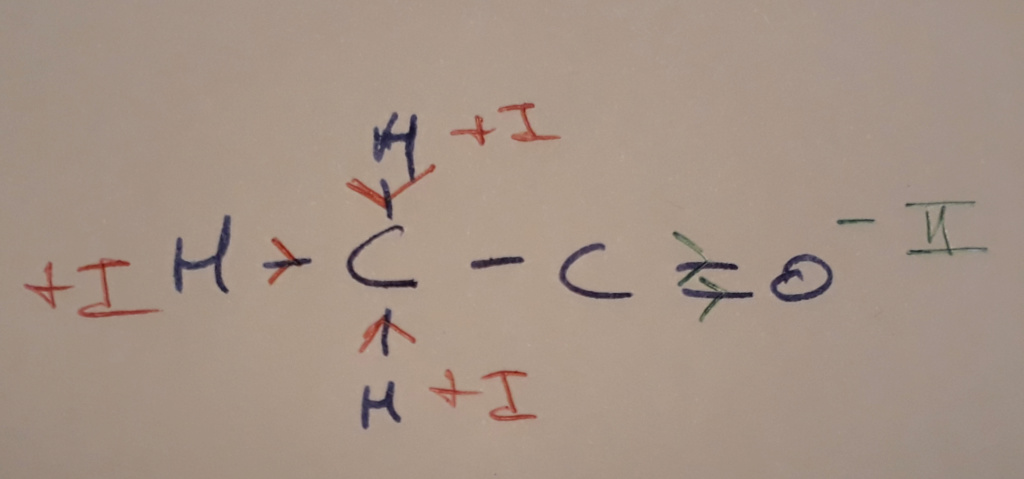
Et encore une fois, le total fait bien 0 !
J'espère que c'est plus clair pour toi désormais !
Pour ton troisième exemple, je te propose de le faire de ton côté, pour voir si tu as bien compris, et de poster ta réponse si tu veux un avis dessus
Bon courage
Le plus simple pour déterminer des nombres d'oxydation, c'est de dessiner ta molécule en formule développée, puis d'y représenter les effets donneurs et attracteurs, en sachant que la somme des nombres d'oxydation de chaque atome est égale à la charge de la molécule (dans tes trois exemples les molécules ne sont pas chargées, donc la somme des nombres d'oxydation sera égale à 0).
On va regarder ensemble tes deux premiers exemples :
1) Si tu représentes la molécule en forme développée tu obtiens ça :
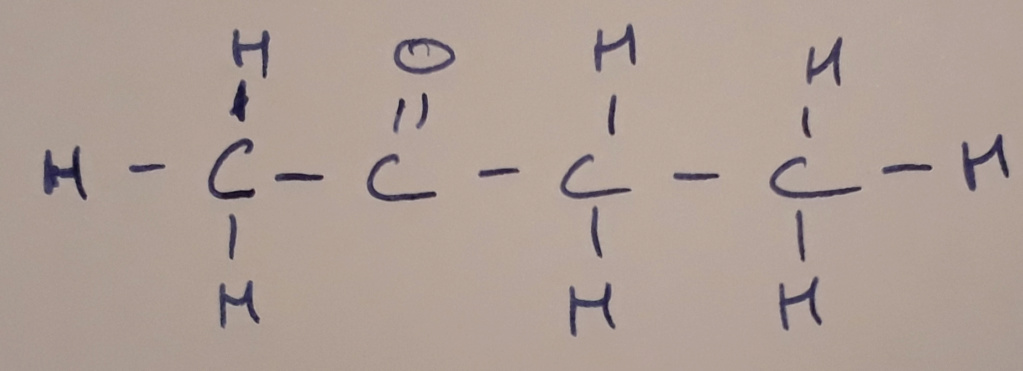
Sachant que l'oxygène est un élément électronégatif, il va attirer les électrons à lui. De plus, il est relié au carbone par une double liaison.
-> Il va donc attirer 2 électrons
L'hydrogène quand a lui a plutôt tendance à être un donneur lorsqu'il est relié à des non-métaux.
-> Il va donc donner 1 électron
De là, tu peux dire que l'oxygène aura pour nombre d'oxydation -II et l'hydrogène +I
Ensuite, tu détermines le nombre d'oxydation de chaque carbone à partir du nombre d'électron qui lui sont donnés ou pris :
- Le premier carbone reçoit 3 électrons (1 par liaison avec un hydrogène), il sera donc en -III
- Le deuxième carbone perd 2 électrons, il sera donc en +II
- Le troisième carbone reçoit 2 électrons, il sera donc -II
- Le quatrième carbone reçoit 3 électrons, il sera donc en -III
Ce qui donne :
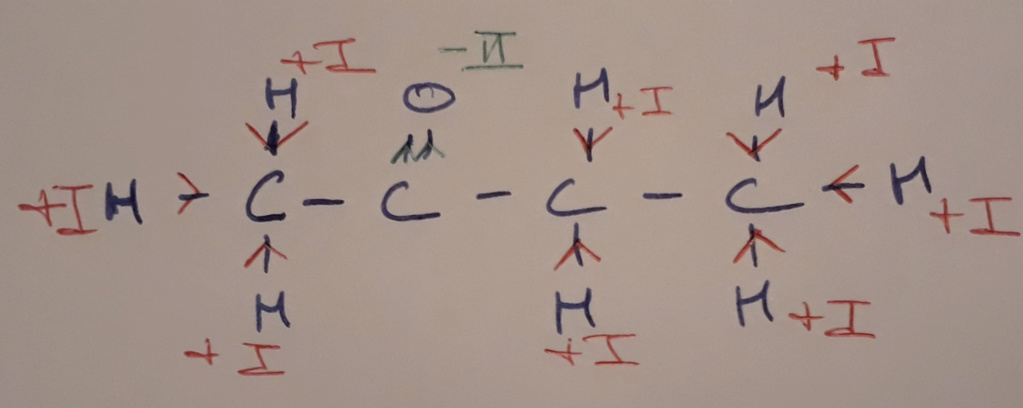
Et on constate que le total de tous les nombre d'oxydation est bien égal à 0
2) La molécule en forme développée :

Ici, tu as encore un oxygène relié à un carbone par une double liaison, il va donc attirer à lui 2 électrons et sera en -II.
Les hydrogènes donnent chacun un électron au carbone qui les porte, il seront tous en +I
Le premier carbone sera alors en -III (il reçoit 3 électrons), et le deuxième carbone en +II
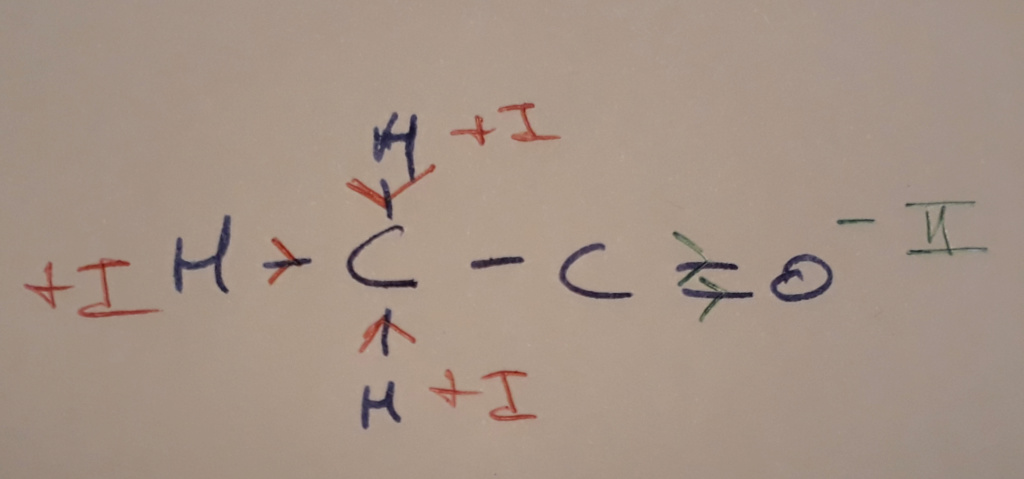
Et encore une fois, le total fait bien 0 !
J'espère que c'est plus clair pour toi désormais !
Pour ton troisième exemple, je te propose de le faire de ton côté, pour voir si tu as bien compris, et de poster ta réponse si tu veux un avis dessus
Bon courage

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE STRUCTURALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum