QCM 5 ENTHALPIE
5 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2017-2018
Page 1 sur 1
 QCM 5 ENTHALPIE
QCM 5 ENTHALPIE
Bonsoir,
J'ai une question concernant l'ex d'enthalpie .. je ne sais pas si cela a déjà été expliqué sur le talc car je ne trouve pas.. donc je vais quand même posé mes questions.
Voila, j'ai compris que à partir de C2H2 et H2O on va d'abord chercher les corps simples car on a les delta de formation.
Mais ensuite comment va t on passer des corps simples à " 2CO2 + 2H2O(l)" Comment savoir que des corps simples on aboutit à cette expression ..??
Puis, si je comprends bien après on va prendre delta de combustion car on aura mis dans notre équation du CO2 et que c'est une donnée.. c'est bien cela ?
Enfin, je ne comprends pas on passe de CH3COOH à CH3CHO en mettant delta d'oxydation or il y a un oxygène en moins donc cela serait une réduction non ...?? A moins, que l'on mette cela car c'est une donnée et ce qui explique le signe moins devant le delta car on a pas le delta réduction donc nous sommes obligés de prendre la valeur de delta oxydation en mettant le signe moins c'est cela ?
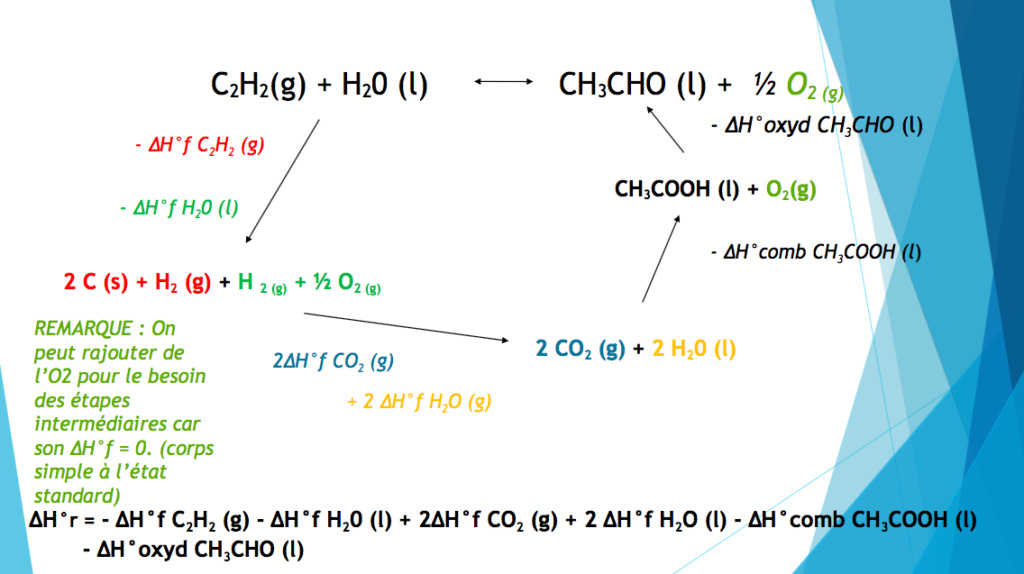
MERCII
J'ai une question concernant l'ex d'enthalpie .. je ne sais pas si cela a déjà été expliqué sur le talc car je ne trouve pas.. donc je vais quand même posé mes questions.
Voila, j'ai compris que à partir de C2H2 et H2O on va d'abord chercher les corps simples car on a les delta de formation.
Mais ensuite comment va t on passer des corps simples à " 2CO2 + 2H2O(l)" Comment savoir que des corps simples on aboutit à cette expression ..??
Puis, si je comprends bien après on va prendre delta de combustion car on aura mis dans notre équation du CO2 et que c'est une donnée.. c'est bien cela ?
Enfin, je ne comprends pas on passe de CH3COOH à CH3CHO en mettant delta d'oxydation or il y a un oxygène en moins donc cela serait une réduction non ...?? A moins, que l'on mette cela car c'est une donnée et ce qui explique le signe moins devant le delta car on a pas le delta réduction donc nous sommes obligés de prendre la valeur de delta oxydation en mettant le signe moins c'est cela ?

MERCII
Tia- Messages : 177
Date d'inscription : 16/10/2017
 Re: QCM 5 ENTHALPIE
Re: QCM 5 ENTHALPIE
Salut !
En réalité tu ne "le sait pas" c'est toi qui décide à partir des corps simples de former du CO2 et H2O car on te donne leur enthalpie de formation
Tu construit ton diagramme à partir de tes données ici tu as des corps simples et tu as les enthalpies de formation donc tu les utilise et ensuite tu vois (comme par hasard) que tu as une enthalpie de combustion donc que tu pourras l'utiliser car une combustion implique du CO2 et H2O
--> tu commences à voir un lien apparaitre
Tu passes de CH3COOH à CH3CO = c'est une réduction (et non pas une oxydation) justement attention il y a un - devant le delta d'oxydation !! --> c'est donc bien l'inverse d'une oxydation
Bon courage !
En réalité tu ne "le sait pas" c'est toi qui décide à partir des corps simples de former du CO2 et H2O car on te donne leur enthalpie de formation
Tu construit ton diagramme à partir de tes données ici tu as des corps simples et tu as les enthalpies de formation donc tu les utilise et ensuite tu vois (comme par hasard) que tu as une enthalpie de combustion donc que tu pourras l'utiliser car une combustion implique du CO2 et H2O
--> tu commences à voir un lien apparaitre
Tu passes de CH3COOH à CH3CO = c'est une réduction (et non pas une oxydation) justement attention il y a un - devant le delta d'oxydation !! --> c'est donc bien l'inverse d'une oxydation
Bon courage !
Gabrielle.G- Messages : 179
Date d'inscription : 15/10/2017
 Re: QCM 5 ENTHALPIE
Re: QCM 5 ENTHALPIE
Salut !
J'ai un question aussi concernant cet exercice :
Pourquoi quand on utilise l'enthalpie de formation de l'eau à l'état gazeux on obtient de l'eau liquide ?
Merci !
J'ai un question aussi concernant cet exercice :
Pourquoi quand on utilise l'enthalpie de formation de l'eau à l'état gazeux on obtient de l'eau liquide ?
Merci !
Marie B- Messages : 20
Date d'inscription : 17/10/2018
 Re: QCM 5 ENTHALPIE
Re: QCM 5 ENTHALPIE
Salut !
C'est une erreur il faut bien utiliser l'enthalpie de formation de l'eau liquide (en jaune sur le diapo)
Désolé et bon courage !!
C'est une erreur il faut bien utiliser l'enthalpie de formation de l'eau liquide (en jaune sur le diapo)
Désolé et bon courage !!
Gabrielle.G- Messages : 179
Date d'inscription : 15/10/2017
 Re: QCM 5 ENTHALPIE
Re: QCM 5 ENTHALPIE
Salut je ne comprends pas pourquoi, on rajoute du CO2 et de l'H2O, pourquoi on les utilise et comment on les trouve?
Clémence29- Messages : 138
Date d'inscription : 19/10/2019
 Re: QCM 5 ENTHALPIE
Re: QCM 5 ENTHALPIE
Salut !
Dans le cadre d'une combustion, on a toujours : réactif + O2 -> CO2 + H2O, avec ajustement des coefficients stœchiométriques pour conserver les quantités de matière.
Donc par exemple ici on nous donne l'enthalpie de combustion du CH3COOH, ce qui donne donc :
CH3COOH + O2 -> CO2 + H2O
On équilibre les C : 2 à gauche, 1 seul à droite, donc on multiplie CO2 par 2 :
CH3COOH + O2 -> 2 × CO2 + H2O
On équilibre ensuite les H : 4 à gauche, seulement 2 à droite, donc on multiplie H2O par 2 :
CH3COOH + O2 -> 2 × CO2 + 2 × H2O
On équilibre finalement les O : 4 à gauche, 6 à droite, donc on multiplie O2 par 2 :
CH3COOH + O2 -> 2 × CO2 + 2 × H2O
Donc l'enthalpie de combustion du CH3COOH correspond à l'énergie produite lors de la réaction CH3COOH + O2 -> 2 × CO2 + 2 × H2O
Est-ce que c'est ok pour toi ?
Dans le cadre d'une combustion, on a toujours : réactif + O2 -> CO2 + H2O, avec ajustement des coefficients stœchiométriques pour conserver les quantités de matière.
Donc par exemple ici on nous donne l'enthalpie de combustion du CH3COOH, ce qui donne donc :
CH3COOH + O2 -> CO2 + H2O
On équilibre les C : 2 à gauche, 1 seul à droite, donc on multiplie CO2 par 2 :
CH3COOH + O2 -> 2 × CO2 + H2O
On équilibre ensuite les H : 4 à gauche, seulement 2 à droite, donc on multiplie H2O par 2 :
CH3COOH + O2 -> 2 × CO2 + 2 × H2O
On équilibre finalement les O : 4 à gauche, 6 à droite, donc on multiplie O2 par 2 :
CH3COOH + O2 -> 2 × CO2 + 2 × H2O
Donc l'enthalpie de combustion du CH3COOH correspond à l'énergie produite lors de la réaction CH3COOH + O2 -> 2 × CO2 + 2 × H2O
Est-ce que c'est ok pour toi ?

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions à propos des colles :: 2017-2018
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum