enthalpie
4 participants
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
 enthalpie
enthalpie
Salut,
J'ai un petit soucis concernât cet exo je comprends le principe mais juste je ne vois pas d'ou apparait le coefficient stoechiométrique 0,5 ... ?? car pour le calcul ce coefficient est primordial .. je pense que c'est pour équilibrer la réaction mais justement je ne vois pas laquelle dans mon exo .. je vous joint la correction et l'ex.
merci de votre aide

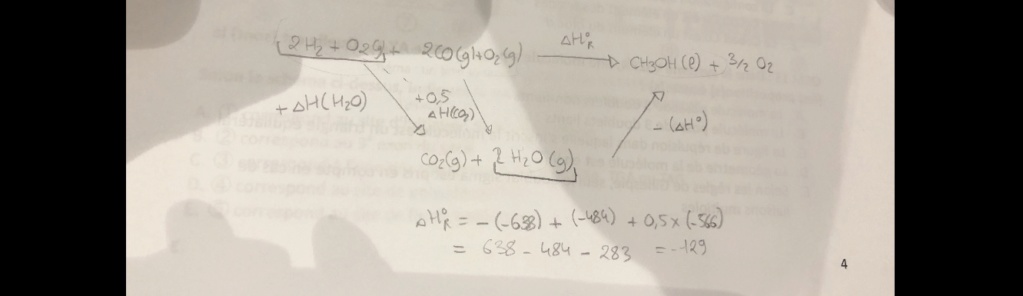
J'ai un petit soucis concernât cet exo je comprends le principe mais juste je ne vois pas d'ou apparait le coefficient stoechiométrique 0,5 ... ?? car pour le calcul ce coefficient est primordial .. je pense que c'est pour équilibrer la réaction mais justement je ne vois pas laquelle dans mon exo .. je vous joint la correction et l'ex.
merci de votre aide


Tia- Messages : 177
Date d'inscription : 16/10/2017
 Re: enthalpie
Re: enthalpie
Salut !
C'est parce que pour la synthèse du dioxyde de carbone, tu formes 1 seule molécule de CO2, et non pas 2 comme dans tes données !
Du coup tu vas utiliser seulement 1 CO + 1/2 O2 pour obtenir 1 CO2, donc tu divises ton enthalpie par 2 (ou tu multiplies par 0,5 c'est pareil).
Si tu ne fais pas ça, ta réaction n'est pas équilibrée, donc ça ne marche pas
C'est parce que pour la synthèse du dioxyde de carbone, tu formes 1 seule molécule de CO2, et non pas 2 comme dans tes données !
Du coup tu vas utiliser seulement 1 CO + 1/2 O2 pour obtenir 1 CO2, donc tu divises ton enthalpie par 2 (ou tu multiplies par 0,5 c'est pareil).
Si tu ne fais pas ça, ta réaction n'est pas équilibrée, donc ça ne marche pas

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: enthalpie
Re: enthalpie
Salut !
En fouillant dans le forum je suis tombée sur cette question et je me permet de la remonter car je me suis retrouvée face à un problème que j'ai rencontré plusieurs fois dans mes exos.
Ici on calcule l'enthalpie. Selon le cours l'enthalpie est égale à l'enthalpie des produits MOINS l'enthalpie des réactifs.
Sauf que dans la colle, au moment du calcul on trouve un - devant l'enthalpie du produit et on additionne les enthalpies de réactifs.
Je ne comprends pas donc à quel moment on additionne, à quel moment on soustrait, c'est assez flou. Est ce que cela dépend aussi de la méthode utilisée ? Si on fait le cycle de Hess, la loi de Hess ou les enthalpies de liaisons etc...
Merci pour vos réponses
En fouillant dans le forum je suis tombée sur cette question et je me permet de la remonter car je me suis retrouvée face à un problème que j'ai rencontré plusieurs fois dans mes exos.
Ici on calcule l'enthalpie. Selon le cours l'enthalpie est égale à l'enthalpie des produits MOINS l'enthalpie des réactifs.
Sauf que dans la colle, au moment du calcul on trouve un - devant l'enthalpie du produit et on additionne les enthalpies de réactifs.
Je ne comprends pas donc à quel moment on additionne, à quel moment on soustrait, c'est assez flou. Est ce que cela dépend aussi de la méthode utilisée ? Si on fait le cycle de Hess, la loi de Hess ou les enthalpies de liaisons etc...
Merci pour vos réponses
amandine_ctn- Messages : 91
Date d'inscription : 22/09/2020
 Re: enthalpie
Re: enthalpie
Salut !
En effet c'est un peu le bordel parce que certaines définitions on changées en même temps que les profs...
En fait, pour M. Kaczmarek une enthalpie de liaison correspond à l'énergie à fournir pour dissocier une liaison, tandis que pour le prof précédent, une énergie de liaison correspondait à l'énergie à fournir pour former une liaison... ce qui inverse carrément le résultat
Du coup les anciennes colles et TK étant basées sur les cours de l'ancien prof, c'est normal que tu sois perdue !
Pour cette année, retiens qu'une enthalpie de liaison est toujours positive (il faut fournir de l'énergie pour briser ta liaison), et retiens les formules du cours :
- Loi de Hess : ∆rH° = (enthalpies de formation des produits) - (enthalpies de formation des réactifs)
- ∆rH° = (énergie de liaison des réactifs) - (énergie de liaison des produits)
Si jamais tu t'entraînes sur des exercices des années précédentes, il faut simplement inverser les signes des enthalpies de liaisons (pour qu'elles soient positives), et de cette façon les formules de cette année fonctionneront !
J'espère que c'est plus clair pour toi malgré tout ce mic-mac !
Bon courage
En effet c'est un peu le bordel parce que certaines définitions on changées en même temps que les profs...
En fait, pour M. Kaczmarek une enthalpie de liaison correspond à l'énergie à fournir pour dissocier une liaison, tandis que pour le prof précédent, une énergie de liaison correspondait à l'énergie à fournir pour former une liaison... ce qui inverse carrément le résultat
Du coup les anciennes colles et TK étant basées sur les cours de l'ancien prof, c'est normal que tu sois perdue !
Pour cette année, retiens qu'une enthalpie de liaison est toujours positive (il faut fournir de l'énergie pour briser ta liaison), et retiens les formules du cours :
- Loi de Hess : ∆rH° = (enthalpies de formation des produits) - (enthalpies de formation des réactifs)
- ∆rH° = (énergie de liaison des réactifs) - (énergie de liaison des produits)
Si jamais tu t'entraînes sur des exercices des années précédentes, il faut simplement inverser les signes des enthalpies de liaisons (pour qu'elles soient positives), et de cette façon les formules de cette année fonctionneront !
J'espère que c'est plus clair pour toi malgré tout ce mic-mac !
Bon courage

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
 Re: enthalpie
Re: enthalpie
Salut !
Heureusement que je me suis baladé sur le forum parce que j'avais pas du tout remarqué que Kaczmarek avait changé ça
Donc si j'ai bien compris : l'H°dissociation de Boury = l'H°liaison de Kaczmarek ?
Mais dans ce cas la à quoi correspond l'H°liaison de Boury pour Kaczmarek ?
Merci beaucoup d'avance
Heureusement que je me suis baladé sur le forum parce que j'avais pas du tout remarqué que Kaczmarek avait changé ça
Donc si j'ai bien compris : l'H°dissociation de Boury = l'H°liaison de Kaczmarek ?
Mais dans ce cas la à quoi correspond l'H°liaison de Boury pour Kaczmarek ?
Merci beaucoup d'avance
yoyo- Messages : 67
Date d'inscription : 22/05/2020
 Re: enthalpie
Re: enthalpie
Eh bien au vu des exercices et du cours de M. Kaczmarek, il n'y a que des enthalpies de liaison, et pas d'enthalpies de dissociation... donc j'imagine que tu peux juste les ignorer !
L'avantage c'est que ça simplifie le truc, une seule définition à connaître, et plus de pièges à la Boury en mettant en données des enthalpies de liaison et de dissociation...
L'avantage c'est que ça simplifie le truc, une seule définition à connaître, et plus de pièges à la Boury en mettant en données des enthalpies de liaison et de dissociation...

Asticoo- Messages : 589
Date d'inscription : 22/09/2017
yoyo aime ce message
Tutorat Licence Santé Lille Catho :: L1 - Chimie, Chimie Organique, Chimie Structurale, Génétique et Biochimie :: Questions de cours et d'ED :: CHIMIE GENERALE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|
